专题3 从矿物到基础材料 知识点题库
(2)取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为 .
(3)在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL FeCl3饱和溶液,继续煮沸至溶液呈 色,即可制得Fe(OH)3胶体.
(4)另取一小烧杯也加入25mL蒸馏水后,向烧杯中也加入2mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中会产生丁达尔效应.此实验可以区别 .
(5)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀盐酸,边滴边振荡,可以看到的现象是 、 , 此变化的离子方程式为 .
(6)已知明矾能净水,理由是 .
 Al+3CO2↑
B . MgO十H2
Al+3CO2↑
B . MgO十H2  Mg+H2O
C . Fe3O4+4CO
Mg+H2O
C . Fe3O4+4CO  3Fe+4CO2
D . 2HgO
3Fe+4CO2
D . 2HgO  2Hg+O2↑
2Hg+O2↑
[铜矿石]  [铜精矿石]
[铜精矿石]  [冰铜]
[冰铜]  [粗铜]
[粗铜]  [电解铜]
[电解铜]
-
(1) 在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.
①该过程中两个主要反应的化学方程式分别是、;
②反射炉内生成炉渣的主要成分是.
-
(2) 冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜.该过程发生反应的化学方程式分别是、.
-
(3) 粗铜的电解精炼如图所示.
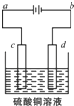
①在粗铜的电解过程中,粗铜板应是图中电极(填图中的字母);
②在电极d上发生的电极反应式为;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为.

部分阳离子完全沉淀时溶液的pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答如下问题:
-
(1) 碱浸的目的是为了除去
-
(2) 某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作
-
(3) 加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为,加入H2O2发生反应的离子方程式为。加入H2O2保温后调pH,下列范围合理的是(填选项序号)。
A.1.8~3.2
B.2.0~3.0
C.3.3~5.2
D.9.2~9.7
-
(4) 滤渣③的主要成分为,滤液③调pH为2~3的目的为
-
(5) 为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为
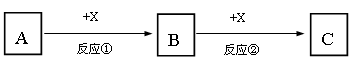
-
(1) 若A、B、C均为含有同种非金属元素的化合物,A为使湿润的红色石蕊试纸变蓝的气体,B接触空气立刻变为C,则反应①的化学方程式为。
-
(2) 若A、B、C为焰色反应均呈黄色的化合物,X为无色无味气体,则反应②的离子方程式为。
-
(3) 若A、B、C均为含有同种金属元素的化合物,X是强碱,则反应②的离子方程式为。
-
(4) 若A为单质Fe,X为稀硝酸,若向B的溶液中加入氢氧化钠溶液,现象为。
-
(5) 若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为。

回答下列问题:
-
(1) 由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、(从下列图中选择,写出名称)。
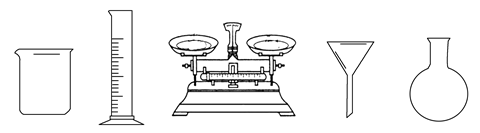
-
(2) 电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。
阳离子
u∞×108/(m2·s−1·V−1)
阴离子
u∞×108/(m2·s−1·V−1)
Li+
4.07

4.61
Na+
5.19

7.40
Ca2+
6.59
Cl−
7.91
K+
7.62

8.27
-
(3) 电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入电极溶液中。
-
(4) 电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=。
-
(5) 根据(3)、(4)实验结果,可知石墨电极的电极反应式为,铁电极的电极反应式为。因此,验证了Fe2+氧化性小于,还原性小于。
-
(6) 实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是。
-
(1) Ⅰ.ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是。
-
(2) Ⅱ.已知一定条件下可以发生下列反应:H2O2+2Fe2++2H+=2Fe3++2H2O、H2O2+2Fe3+=2Fe2++2H++O2↑
与上述反应类比,I2也能与H2O2发生类似反应。请在空格处填入合适的化学方程式:H2O2+I2=2HIO;;总反应的化学方程式为。
-
(3) 在H2SO4和KI的混合溶液中加入过量的H2O2 , 放出大量的无色气体,溶液呈棕色,并可以使淀粉溶液变蓝。有同学认为该反应的离子方程式为H2O2+2I-=I2+O2↑+2H+ , 该离子方程式是否正确(填“正确”或“不正确”),理由是。
-
(4) 在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4 , 此反应的离子方程式为。
①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在呼吸面具中做供氧剂 ④铁丝在氯气中燃烧生成棕黄色的FeCl3 ⑤钠、氢气在氯气中燃烧都能产生白烟
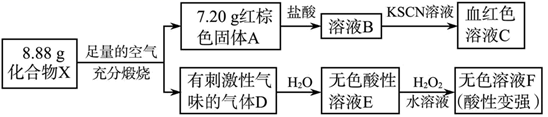 请回答:
请回答:
-
(1) X中含有的元素是
-
(2) 请写出E反应生成F的化学方程式
-
(3) 化合物X与盐酸反应,溶液除了变浑浊之外还会释放出一种气体,请写出该反应的离子方程式

A | B | C | D |
|
|
|
|
高纯硅用于制作信息产业芯片 | 铝合金用于建设高铁 | 铜用于生产5G基站的电路板 | 聚乙烯醇用于制作人造软骨组织 |