专题3 从矿物到基础材料 知识点题库
下列试剂可用带玻璃塞的玻璃瓶存放的是()
A . NaOH溶液
B . 石灰水
C . 盐酸
D . 氢氟酸
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书.

-
(1) 该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 硫氰化钾溶液 ( 填试剂的名称 )
②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应).请配平下列离子方程式
MnO4﹣+ Fe2++ H+═ Mn2++ Fe3++ H2O
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液,取出20.00mL,用0.01mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL.该药品可以服用吗? (填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程) .
-
(2) 已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方 程式(有机物须写结构简式) ,琥珀酸亚铁的化学式为 .
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸反应的产物,下列有关说法正确的是( )

A . 品红溶液的作用是吸收SO2 , 防止污染空气
B . 试管②中盛放的试剂通常是NaOH溶液
C . 试管①中有白色固体生成,向①中加水后溶液呈蓝色
D . 该反应中浓硫酸既表现了强氧化性,又表现了酸性
在人类社会的发展进程中,金属起着重要的作用.下列说法正确的是( )
A . 地球上绝大多数金属元素是以游离态存在于自然界中的
B . 在化学反应中,金属容易失去电子,是还原剂
C . 多数合金的熔点高于组成它的成分的金属的熔点
D . 硅单质是良好的半导体,所以它是金属元素
美国“海狼”潜艇上的核反应堆内使用了液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
A . 原子半径:Na>Al
B . 若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na)
C . m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小
D . 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成
以下物质间的每步转化通过一步反应能实现的是( )
A . Fe﹣FeCl2﹣FeCl3﹣Fe(OH)3
B . Al﹣Al2O3﹣Al(OH)3﹣NaAlO2
C . S﹣SO3﹣H2SO4﹣MgSO4
D . N2﹣NO2﹣NO﹣HNO3
甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素。甲、乙、丙、丁之间的转化关系如右图所示,则乙不可能是( )

A . Al(OH)3
B . FeCl3
C . CO
D . Na2CO3
通过实验得出的结论正确的是( )
A . 将某固体试样完全溶于盐酸,再滴加Ba(NO3)2溶液,出现白色沉淀,则该固体试样中存在SO42-
B . 将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,则该固体试样中不存在Fe3+
C . 在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NH4+
D . 在某固体试样加水后的上层清液中,滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,则该固体试样中存在SiO32-
下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用淀粉-KI溶液鉴别FeCl2和FeCl3 | Fe2+有氧化性 |
| C | CuSO4可以用作游泳池消毒 | 铜盐能使蛋白质变性 |
| D | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
A . A
B . B
C . C
D . D
镁、铝合金粉末 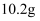 溶于
溶于 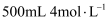 盐酸中且恰好完全反应,若加入
盐酸中且恰好完全反应,若加入  的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
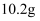 溶于
溶于 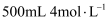 盐酸中且恰好完全反应,若加入
盐酸中且恰好完全反应,若加入  的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为( )
A .  B .
B . 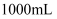 C .
C . 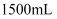 D .
D . 
 B .
B . 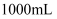 C .
C . 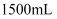 D .
D . 
下列有关金属材料的说法错误的是( )
A . 铁有良好的导热性,常用来制作炊具
B . 铜的化学性质不活泼,因此可用于制导线
C . 废旧电池中汞的回收可减少对环境的污染
D . 钛合金与人体有很好的相容性,因此可用来制造人造骨
化学与生活联系密切,下列说法正确的是( )
A . 《新修本草》中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑙璃,烧之赤色”这里的赤色是析出了Cu单质
B . 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C . 高纯度的单晶硅可用于制造太阳能电池板和光导纤维
D . 酸雨既能腐蚀建筑物也能破坏农作物
下列物质的转化在给定条件下能实现的是( )
A . NaCl(ag) 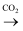 NaHCO3(s)
NaHCO3(s)  Na2CO3(s)
B . Si
Na2CO3(s)
B . Si  SiO2
SiO2  H2SiO3
C . CuCl2
H2SiO3
C . CuCl2  Cu(OH)2
Cu(OH)2  Cu2O
D . MgO(s)
Cu2O
D . MgO(s)  Mg(NO3)2 (aq)
Mg(NO3)2 (aq)  Mg(s)
Mg(s)
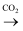 NaHCO3(s)
NaHCO3(s)  Na2CO3(s)
B . Si
Na2CO3(s)
B . Si  SiO2
SiO2  H2SiO3
C . CuCl2
H2SiO3
C . CuCl2  Cu(OH)2
Cu(OH)2  Cu2O
D . MgO(s)
Cu2O
D . MgO(s)  Mg(NO3)2 (aq)
Mg(NO3)2 (aq)  Mg(s)
Mg(s)
下列有关物质的性质和该性质的应用均正确的是( )
A . 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸
B . 二氧化硅不与任何酸反应,可用石英制造耐酸容器
C . 工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质
D . 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
化学与生产、生活密切相关。下列与化学相关的说法正确的是 ( )
A . 水泥、陶瓷、水晶均属于硅酸盐产品
B . 医用酒精和Fe(OH)3胶体可用丁达尔效应区分
C . 氯水和食盐水消毒杀菌的原理相同
D . 盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
在一定条件下,下列选项中括号内的物质能被完全消耗掉的是( )
A . 常温下将64g铜片投入足量浓硫酸中(铜片)
B . 向含有0.2molBa(OH)2和0.1molNaOH的混合溶液中通入标况下3.36LCO2(CO2)
C . 向10mL3mol•L-1的盐酸中加入5.6g铁(铁)
D . 向5.5gMnO2粉末中加入20mL2mol•L-1双氧水(MnO2)
下列关于二氧化硅的说法中正确的是( )
A . 二氧化硅分子由一个硅原子和两个氧原子构成
B . 在二氧化硅晶体中,每个硅原子周围结合 4 个氧原子
C . 二氧化硅可用来制作干燥剂,因二氧化硅可与水反应
D . 二氧化硅是酸性氧化物,它不溶于任何酸
如图所示,某同学用部分短周期元素制作了一个非常有趣的“钟表”,下列有关该“钟表”的说法正确的是( )

A . 12:00时“时针”所指元素的金属性最强
B . 从中午12:00点到下午6:00点,“时针”所指元素的金属性依次减弱
C . 8:55时“时针”和“分针”所指的两种元素(“针”所指以最近为准)形成的化合物中阴、阳离子之比为1:1
D . 2:00时,“时针”和“分针”所指的元素的原子最外层均只有两个电子,性质相似
根据实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向CuSO4溶液中通入H2S,生成黑色沉淀(CuS) | H2S的酸性比H2SO4强 |
| B | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
| C | 向NaCl和NaBr混合溶液中滴加少量AgNO3溶液,出现淡黄色沉淀(AgBr) | Ksp(AgCl)>Ksp(AgBr) |
| D | 在酒精灯上加热铝箔,铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
A . A
B . B
C . C
D . D
三氯化铁溶液可腐蚀印刷电路板上的铜膜,腐蚀废液会污染环境.某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为腐蚀液原料循环使用,其流程如下:

回答下列问题:
-
(1) 操作Ⅰ的名称.
-
(2) 滤渣①中的成分(用化学式表示).
-
(3) 若选用Cl2作试剂B,则“转化”过程中发生反应的离子方程式为;若从“绿色化学”的角度来考虑,试剂B可以是.
-
(4) 取少量滤液②于试管中加入NaOH溶液,生成了白色絮状沉淀后迅速变成灰绿色,过一段时间会生成红褐色物质,请写出生成红褐色物质时发生的化学反应方程式.
-
(5) 把1.0mol/L CuCl2溶液和2.0mol/L FeCl3溶液等体积混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入过量铁粉,经过足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度是.
最近更新



