专题3 从矿物到基础材料 知识点题库
某化学兴趣小组用回收的镁铝合金制取氢气。现有10.8g镁铝合金,下列说法正确的是( )
A . 常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6molH2
B . 常温下与足量2mol/LHNO3溶液反应,最少可放出0.45molH2
C . 常温下与足量2mol/LH2SO4溶液反应,放出H2的物质的量在0.45~0.6mol之间
D . 常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0.45~0.6mol之间
要想证明某溶液中是否含有Fe3+ , 下列操作中正确的是( )
A . 加入铁粉
B . 滴加KSCN溶液
C . 通入氯气
D . 加入铜片
我们看到的普通玻璃一般呈淡绿色,这是因为在制造玻璃的过程中加入了( )
A . 氧化钴
B . 二价铁
C . 氧化亚铜
D . 氧化镁
下列实验方法正确的是( )
A . 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水
B . 某气体能使品红溶液褪色,该气体一定为SO2
C . 用饱和NaHCO3溶液除去混在Cl2中的HCl气体
D . 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4
有相同的三块铝片,进行如下实验
实验一:取第一块铝片,直接放入硫酸铜溶液中观察现象
实验二:取第二块铝片,用砂纸擦试表面后,放入硫酸铜溶液中观察现象
实验三:将实验一中铝片从硫酸铜溶液中取出,洗净后放入氢氧化钠溶液中,片刻后取出铝片,洗净后再放入硫酸铜溶液中观察现象
实验四:取第三块铝片,用砂纸擦试表面后,置于浓硝酸中,片刻后取出,洗净,再放入硫酸铜溶液中观察现象
综合以上四个实验的主要目的是试图说明( )
A . 铝片能和硫酸铜溶液反应
B . 铝片能和氢氧化钠溶液反应
C . 铝片不能和硝酸反应
D . 铝片表面能形成具有保护作用的氧化膜
类比推理是化学学习中的一种重要方法.下列类推结论中,正确的是( )
类比对象 | 结论 | |
A. | Cl2+H2O═HCl+HClO | I2+H2O═HI+HIO |
B. | Cl2+2Fe2+═2Fe3++2Cl﹣ | I2+2Fe2+═2Fe3++2I﹣ |
C. | S+Fe═FeS | S+Cu═CuS |
D. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O ═CaSO3↓+2HClO |
A . A
B . B
C . C
D . D
某溶液中有Mg2+、Fe2+、Cu2+三种离子,向其中加入过量的NaOH溶液后过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是( )
A . Mg2+
B . Fe2+
C . Cu2+
D . 无减少
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如图,b处NaOH的体积为1L,则下列判断正确的是( )

A . 混合溶液中Al3+的物质的量为0.2mol
B . NaOH的浓度为0.5 mol/L
C . 在b点处溶液中的溶质只有NaAlO2
D . 图中线段oa:ab=5:1
光导纤维被认为是20世纪最伟大的发明之一。2009年诺贝尔物理学奖获奖者英国华裔科学家高锟,在“有关光在纤维中的传输以用于光学通信方面”取得了突破性成就。光导纤维的主要成分是( )
A . Si
B . SiO2
C . Na2SiO3
D . SiCl4
下列药品和装置合理且能完成相应实验的是( )
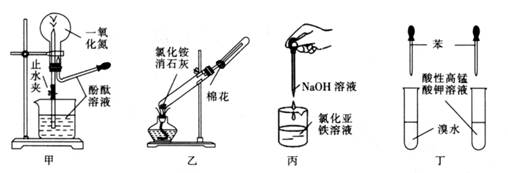
A . 甲图为喷泉实验
B . 乙图为实验室制取并收集氨气
C . 丙图为制备氢氧化亚铁的实验
D . 丁图为验证苯中是否有碳碳双键的实验
下列关于硅及其化合物的说法正确的是( )
A . 硅酸盐中的阴离子都是SiO32-
B . 单质硅可用于制造光导纤维
C . 二氧化硅既可以与烧碱溶液反应又能与氢氟酸反应,故属于两性氧化物
D . Na2SiO3是最简单的硅酸盐,其水溶液可用作木材防火剂
A,B,C,D四种强电解质溶液分别含有下列阴、阳离子中的各一种且不重复:NH  、Ba2+、H+、Na+、SO42-、CO32-、NO3-、OH﹣已知:①向A或D中滴入C,均有沉淀生成:
、Ba2+、H+、Na+、SO42-、CO32-、NO3-、OH﹣已知:①向A或D中滴入C,均有沉淀生成:
②向A和B中分别滴加D(可加热)均有气体生成(又已知:D和B反应生成的气体能被A吸收),且这两种气体在水中能反应生成D。 试回答下列问题:
-
(1) 写出A,B,C,D四种溶液中溶质的化学式:
A,B,C,D。
-
(2) 将A与D反应生成的气体缓慢通入含KOH、Ca(OH)2、NaAlO2的混合溶液中,生成沉淀的物质的量n与通入气体的体积V的关系可表示(填字母)。

实验室里研究不同价态硫元素之间的转化
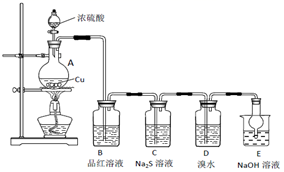
-
(1) A中发生反应的化学方程式为。
-
(2) B中的现象是。
-
(3) C中出现淡黄色沉淀,反应中Na2S做 (填“氧化剂”或“还原剂”)。
-
(4) D溴水褪色,该反应S元素的价态变化是由+4价变为价。
-
(5) 某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,。
-
(6) E的作用是,离子方程式为。
-
(7) 上述实验体现SO2 的性质有。
下列说法正确的是( )
A . MgO和Al2O3都属于两性氧化物
B . 悬浊液和乳浊液的分散质均为液态
C . Fe3O4和Pb3O4中的金属都呈现两种价态
D . 葡萄糖和淀粉都属于还原性糖
下列离子的检验方法合理的是( )
A . 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
B . 向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
C . 向某溶液中通入Cl2 , 然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
D . 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+ , 不含有Mg2+
把a、b、c、d四块金属浸入稀硫酸中,用导线两两连接组成多个原电池,若a、b相连,a为负极;c、d相连,d上有气泡逸出;a、c相连,a极减轻;b、d相连,b为正极。则四种金属的活泼性顺序为 ( )
A . a>b>c>d
B . a>c>b>d
C . a>c>d>b
D . b>d>c>a
下列有关物质性质或概念的叙述错误的是( )
A . 焰色试验可以判断某种金属元素的存在
B . 甲烷燃烧释放能量是因为甲烷键能大
C . 太阳能电池的主要材料是高纯硅
D . 物质间发生化学反应时,化学键一定发生变化
经过202天的飞行,2021年2月10日19时52分,“天问一号”成功“刹车”,成为我国第一颗人造火星卫星。下列关于“天问一号”的化工材料叙述正确的是( )
A . 探测器的结构材料大多采用高强度的不锈钢
B . 火星车温控涂层材料聚酰胺薄膜属于合成有机高分子材料
C . 太阳能电池用于导电元件的主要成分为二氧化硅
D . 制造大型抛物面天线的铝合金或玻璃钢均为金属材料
化学科学与生产、生活密切相关。下列说法正确的是( )
A . 增加食品添加剂的品种与数量保证食物口感
B . 用海水海沙生产混凝土在海边建筑工程施工
C . 用铝粉和氧化铁组成的铝热剂用于焊接钢轨
D . 加快化石燃料的开采来促进社会可持续发展
下列实验操作、现象及结论都正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 用铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 该溶液中可能含有 |
| B | 取少量溶液 | 该溶液中含有 |
| C | 取少量金属 | 该白色固体为 |
| D | 将金属 | 说明 |
A . A
B . B
C . C
D . D
最近更新

 加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
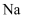 放在坩埚中灼烧,产生白色固体
放在坩埚中灼烧,产生白色固体
 活泼
活泼


