专题3 从矿物到基础材料 知识点题库
把过量的CO2气体通入下列物质的饱和溶液中,不变浑浊的是( )
A . Ca(OH)2
B . C6H5ONa
C . NaAlO2
D . Na2SiO3
有下列物品或设备:
①陶瓷餐具 ②砖瓦③水泥路桥 ④门窗玻璃⑤水晶镜片 ⑥石英钟表⑦玛瑙手镯 ⑧硅太阳电池⑨光导纤维 ⑩计算机芯片
-
(1) 用到硅单质的是.
-
(2) 所用材料为SiO2或要用到SiO2的是
-
(3) 所用材料为硅酸盐的是.
光电池(Solar cell)可用作计算器、人造卫星的动力,如图所示.下列分析正确的是( ) 

A . 硅是将太阳能转换为电能的常用材料
B . 玻璃盖板是由纯碱、石灰石与石英制得的晶体
C . 支架用铝合金而不用铝是利用了其熔点高于铝的特点
D . 光电池制造中不会产生任何化学污染
下列物质性质与应用对应关系正确的是( )
A . 氯化镁属于电解质,工业上可用电解其溶液的方法制镁
B . 钠钾合金的硬度小,可用作快中子反应堆的热交换剂
C . Fe2O3是红棕色固体,可以制成红色的油漆、涂料
D . 溴单质在CCl4中的溶解度大,可用CCl4萃取Br﹣
下列说法不正确的是( )
A . “光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关
B . 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
C . SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
D . 焰火的五彩缤纷是某些金属元素的性质的展现
下列说法错误的是( )
A . 纯铁的抗腐蚀能力比生铁强
B . 可用酒精洗涤附着在试管内壁上的固态硫
C . 用惰性电极电解熔融NaCl可获得金属钠
D . 二氧化硅能与NaOH溶液反应,所以盛放碱液的试剂瓶不能用磨口玻璃塞
“单质→氧化物→酸或碱→盐”,以下单质不能完成这种一步转化的是( )
A . 硫
B . 碳
C . 铜
D . 钙
高纯度的单晶硅生产方法主要为:
SiO2  粗硅
粗硅  Si(纯)
Si(纯)  单晶硅
单晶硅
制得的粗硅中含有的杂质主要为(写化学式)
请分别写出上述流程中①、③的化学方程式:①③.
甲、乙两烧杯中各盛有100mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙 = 1:2,则加入铝粉的质量为( )
A . 5.4g
B . 3.6g
C . 2.7g
D . 1.8g
CuSO4溶液与Na2CO3溶液混合时产生蓝绿色沉淀,某实验小组进行实验,探究蓝绿色沉淀的组成。
【查阅资料】
i.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ii.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
iii.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3•yCu(OH)2]
-
(1) 假设1中产生沉淀Cu(OH)2的离子方程式是。
-
(2) 甲同学认为假设2不成立,理由是。
-
(3) 【定性实验】
实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到,证明假设3成立。
-
(4) 【定量实验】
为了确定碱式碳酸铜化学式中x与y的关系,实验小组称取净化后的蓝绿色固体m1 g,使用下列装置(夹持仪器未画出)进行实验。

B,C,D中的试剂依次为(填标号)。
a.澄清石灰水
b.碱石灰
c.氯化钙溶液
d.浓硫酸
-
(5) 各装置接口的连接顺序:a→(填字母序号)。
-
(6) 装置D的作用是。
-
(7) 加热到固体完全分解,硬质玻璃管中得到黑色固体,其余产物被相应装置完全吸收。实验结束后,测得装置B的质量增加m2 g,则xCuCO3•yCu(OH)2中
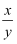 =(列式表示)。若无D装置,则
=(列式表示)。若无D装置,则 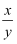 的值(填“偏大”或“偏小”或“无影响”)。
的值(填“偏大”或“偏小”或“无影响”)。
为了检验某FeCl2溶液是否变质,可向溶液中加入的最佳试剂是( )
A . NaOH溶液
B . 铁片
C . KSCN溶液
D . 石蕊溶液
Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
|
实验步骤 |
实验操作 |
|
Ⅰ |
取一定质暈的FeCO3固体置于………中,高温煅烧至质量不再减轻,冷却至室溫 |
|
Ⅱ |
取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
|
Ⅲ |
向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论: 
-
(1) Ⅰ中横线处所需的化学仪器为。
-
(2) 写出实验步骤Ⅲ中发生反应的离子方程式。
-
(3) 乙同学提出不同看法:煅烧产物可能是Fe304 , 因为Fe304也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是(填序号)。
a.氯水
b.氯水和KSCN溶液
c.酸性高锰酸钾溶液
-
(4) 丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是。
-
(5) 丙同学进一步査阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、(填名称)和(填名称);再(填操作名称),灼烧,即可得到Fe2O3。
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是( )
A . Na+、K+、AlO2- 、CO32-
B . Ag+、Cu2+、NO3-、Cl-
C . Mg2+、Fe3+、I-、SO42-
D . NH4+、K+、SO42-、CO32-
现有 A.三氧化二铝 B.三氧化二铁 C.过氧化钠 D.碳酸氢钠,E氨水。请你根据已有的知识,选择合适的物质,用字母代号填空:
-
(1) 常作为潜水艇和呼吸面具中氧气来源的淡黄色固体是;
-
(2) 属于两性氧化物的是;
-
(3) 常用于焙制糕点,也可用作抗酸药的是;
-
(4) 红棕色固体是。
-
(5) 属于盐的是,
-
(6) 属于混合物的是,
下列试剂不能用来检验溶液中  的是( )
的是( )
 的是( )
的是( )
A . 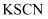 溶液
B .
溶液
B .  溶液
C . 乙醇溶液
D .
溶液
C . 乙醇溶液
D .  溶液
溶液
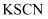 溶液
B .
溶液
B .  溶液
C . 乙醇溶液
D .
溶液
C . 乙醇溶液
D .  溶液
溶液
在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀盐酸,完全反应后,离子数目几乎没有改变的是( )
A . Fe2+
B . Fe3+
C . Al3+
D . NH4+
以下是四位同学在学习了《化学必修一》后,对一些知识的认识,你认为正确的是( )

A . A
B . B
C . C
D . D
有一稀硝酸和稀硫酸的混合溶液10mL,其中硝酸和稀硫酸的浓度分别为2molL−1和4molL−1,向其中加入过量的铁粉(设反应中HNO3的还原产物只有NO)充分反应。
-
(1) 用两个离子方程式表示整个反应过程,。
-
(2) 可产生标准状况下气体的体积为mL。
下列化学方程式或离子方程式书写正确的是( )
A . 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B . 向饱和NaOH溶液中通入过量CO2:2OH-+CO2=CO  +H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)
+H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)  Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO
Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO  =BaSO4↓
=BaSO4↓
 +H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)
+H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)  Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO
Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO  =BaSO4↓
=BaSO4↓
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。

-
(1) 甲装置中发生的主要反应的化学方程式是,
该反应中若有6.4gCu参加反应,则被还原的H2SO4的物质的量为 mol。
-
(2) 在装置乙的试管口放有一团浸有碱液的棉花,若棉花中碱液为氢氧化钠溶液,请写出棉花中发生反应的离子方程式:。
已知甲中生成的还原产物具有较强还原性,试书写其与盐酸酸化的FeCl3溶液反应的离子方程式:。
-
(3) 欲观察甲装置中生成CuSO4溶液的蓝色,应进行的操作是。
最近更新



