第3节 氧化剂和还原剂 知识点题库
在反应 3S + 6NaOH  2Na2S + Na2SO3 + 3H2O 中被氧化的硫与被还原的硫的关系是 ( )
2Na2S + Na2SO3 + 3H2O 中被氧化的硫与被还原的硫的关系是 ( )


已知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同.
请回答下列问题:
-
(1) 第一次氧化时,溶液的pH应调节为(填“酸性”、“碱性”或“中性”);原因是.反应中,欲使1mol NaCN变为NaOCN,则需要氧化剂NaClO至少为mol.
-
(2) 写出第二次氧化时发生反应的离子方程式:.反应中被氧化的元素是.
-
(3) 处理10m3含NaCN 10.3mg/L的废水,实际至少需NaClOg(实际用量应为理论值的4倍),才能使废水中NaCN含量达到排放标准.
-
(1) NaNO2中N的化合价为.
-
(2) 该反应中的氧化剂是,氧化产物为.
-
(3) 为了获取反应后溶液中的 I2 , 可采用选择有机溶剂CCl4萃取的实验方法,选择CCl4做萃取剂的原因是.
-
(4) 该反应中,氧化产物与还原产物的物质的量之比为.
-
(5) NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,区别这两种物质的实验操作方法是.
-
(6) 若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为NA(NA表示阿伏加德罗常数的值),发生反应的NaNO2的质量为g.
 NaCl+N2↑+2H2O;关于该反应的下列说法错误的是( )
NaCl+N2↑+2H2O;关于该反应的下列说法错误的是( )
 Na2CO3+H2O+CO2↑
C . NH3+HCl=NH4Cl
D . CuO+H2
Na2CO3+H2O+CO2↑
C . NH3+HCl=NH4Cl
D . CuO+H2  Cu+H2O
Cu+H2O
-
(1) FeCl3溶液呈黄色,FeCl3溶液的分散质是,分散剂是。
-
(2) Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是
-
(3) Fe(OH)3胶体呈红褐色,具有良好的净水效果。由饱和FeCl3溶液制备 Fe(OH)3胶体的化学方程式是。
-
(4) 鉴别FeCl3溶液和Fe(OH)3胶体,除了可通过观察颜色以外,还有的方法是。
-
(5) 下列关于Fe(OH)3胶体和Fe(OH)3悬浊液的描述,正确的是_______A . 两者颜色相同 B . 两者稳定性相同 C . 两者的分子直径均大于100nm D . 滴加稀盐酸后,两者现象完全相同
-
(6) 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业制备高铁酸钠 有多种方法,其中一种方法的原理可用离子方程式表示为 3ClO-+2Fe3++10OH-=2FeO
 +3Cl-+5H2O,则Na2FeO4中铁元素的化合价为,该离子反应中氧化剂与还原剂的个数比为,生成1个高铁酸钠转移 个电子。
+3Cl-+5H2O,则Na2FeO4中铁元素的化合价为,该离子反应中氧化剂与还原剂的个数比为,生成1个高铁酸钠转移 个电子。
-
(1) 物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液的pH7 (选填“>”、“<”或“=”,下同),所用醋酸体积氢氧化钠溶液体积。
-
(2) 亚磷酸(H3PO3)是二元弱酸,已知常温下H3PO3的电离常数的值:Ka1=3.7×10-2 , Ka2=2.9×10-7。则NaH2PO3溶液显性。(选填“酸”、“碱”或“中”)
-
(3) 某化学兴趣小组利用0.1mol/L的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。
①已知亚磷酸(H3PO3)具有较强的还原性,能被酸性KMnO4溶液氧化为磷酸,且磷酸在水溶液中主要以分子形式存在,请写出该滴定反应的离子方程式:。
②该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,用上述酸性KMnO4标准溶液进行滴定,三次滴定的测量数据如表,则滴定终点的现象为:。该亚磷酸溶液的物质的量浓度为mol/L。(保留小数点后两位)
试验编号
滴定前读数(mL)
滴定后读数(mL)
1
0.00
22.00
2
0.50
22.50
3
0.50
25.50
-
(4) 某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是_______。A . 实验中所用到的滴定管、容量瓶,在使用前均需要检漏; B . 如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶; C . 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小; D . 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大; E . 配制溶液时,读取量筒读数时俯视读数,则导致最后实验结果偏小。 F . 中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大。
-
(5) t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=。
①该温度下(t℃),将100mL 0.1mol•L-1的稀H2SO4溶液与100mL 0.4mol•L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=。
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:。
|
消毒剂类型 |
成分 |
使用主要注意事项 |
|
含氯消毒剂 |
①84消毒液,有效成分NaClO ②漂白粉,有效成分Ca(ClO)2 |
对织物有漂白作用,不能与洁厕灵混用 |
|
醇类消毒剂 |
乙醇含量为70%-80% |
易燃,远离火源 |
|
过氧化物类消毒剂 |
①过氧化氢消毒剂 ②过氧乙酸消毒剂 |
有腐蚀性,对眼睛、粘膜和皮肤有刺激性,有灼伤危险,受热易分解 |
据信息回答问题:
-
(1) 下列说法错误的是____(填标号)。A . 明矾可用作自来水的消毒剂 B . 浓度为95%的酒精消毒效果比75%的医用酒精好 C . 漂白粉既可以漂白棉、麻、纸张,又可作游泳池及环境的消毒剂 D . 含氯消毒剂和过氧化物类消毒剂的消毒原理均是利用了它们的强氧化性 E . 过氧化物类消毒剂对眼睛、粘膜和皮肤有刺激性,配制和使用时建议佩戴口罩、防护镜和手套
-
(2) 84消毒液不能与洁厕灵(主要成分为盐酸)混用,若混用会产生氯气而使人中毒,请写出该反应的离子方程式。
-
(3) 双氧水消除采矿业废液中所含氰化物(KCN)的化学方程式为:KCN+H2O2+H2O=A+NH3↑,生成物A的化学式为。若标准状况下有44.8L氨气生成,则转移的电子数为,反应中被还原的元素是。
 代表阿伏加德罗常数的值,下列叙述正确的是( )
代表阿伏加德罗常数的值,下列叙述正确的是( )
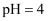 的醋酸溶液中由水电离出的
的醋酸溶液中由水电离出的  的数目为
的数目为  B .
B .  含有
含有 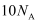 个电子
C .
个电子
C .  与
与  浓盐酸混合,反应转移电子的数目为
浓盐酸混合,反应转移电子的数目为  D . 溶质为
D . 溶质为  的溶液中,含有的
的溶液中,含有的  离子的数目为
离子的数目为 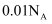
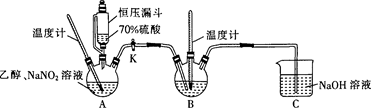
I.实验操作:
①向装置A的三颈烧瓶中加入乙醇20 g、亚硝酸钠40 g、水60 g后,混合均匀;
②将装置A的三颈烧瓶中的混合液体加热到35 ℃左右,控制滴入70%硫酸的速率;
③在装置B的三颈烧瓶中预装由水合肼(N2H4• H2O、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(C2H5ONO)进入装置B中,控制温度在70-90 ℃内,持续加热40 mino
II.部分药品的性质如下表:
| 密度/g • cm-3 | 熔点/°c | 沸点/°c | 溶解性 | |
| 乙醇 | 0.816 | -114 | 7& 4 | 与水以任意比例互溶,可与醚、氯仿、丙酮混溶 |
| 亚硝酸乙酯 | 0. 90 | -93 | 17.2 | 不溶于水,可溶于乙醇、乙醚 |
| 叠氮化钠 | 1. 85 | 275 | 300 | 易溶于水和液氨,微溶于乙醇,不溶于乙醚 |
已知:2C2 H5OH+H2SO4+2NaNO2  2C2 H5ONO↑ +Na2SO4+2H2Oo
2C2 H5ONO↑ +Na2SO4+2H2Oo
回答下列问题:
-
(1) 连接好装置后,进行的第一步操作是。
-
(2) 对装置B中液体进行加热,合适的加热方式为。
-
(3) 装置A中用恒压漏斗代替分液漏斗的优点是;缓慢滴加硫酸,控制滴入速率的原因是。
-
(4) 装置B中水合腓、亚硝酸乙酯和氢氧化钠在80 ℃时反应生成叠氮化钠、乙醇等物质,该反应的化学方程式为。
-
(5) 产品的分离:将装置B中反应后的混合液倒入蒸馏烧瓶中,加热到80-90 ℃,除去混合物 中的乙醇。将蒸馏后所得母液降温结晶,过滤得到叠氮化钠晶体,再用去离 子水重结晶得NaN3产品。冷凝管中的冷却水要“b进a出”的原因是。
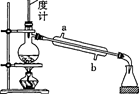
-
(6) 产品纯度测定:取6.5g产品,加入足量蒸馏水溶解,并加入适量稀硫酸酸化,向混合液中加入20.00mL1mol·L-1KMnO4溶液(l0NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑),反应后溶液呈紫红色。再用0.2mol•L-1的Na2SO3标准液滴定过量的KMnO4溶液,到达滴定终点时消耗标准液25.00mL
①到达滴定终点时的现象为。
②叠氮化钠的纯度为。
 (反应未配平),下列说法正确的是( )
(反应未配平),下列说法正确的是( )
 时,反应转移电子数为4NA
C . 将充分分解后所得的气体收集于一密闭容器中,充分静置反应,所得溶液中硝酸与水的物质的量之比为1:1
D .
时,反应转移电子数为4NA
C . 将充分分解后所得的气体收集于一密闭容器中,充分静置反应,所得溶液中硝酸与水的物质的量之比为1:1
D .  中的铜元素被氧化
中的铜元素被氧化

-
(1) 图中A、C、F三种物质中,属于电解质的是(用化学式表示)。
-
(2) F的浓溶液与少量铁单质在一定条件下可以发生反应,该反应的化学方程式为。
-
(3) 将A与D混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为。
-
(4) Na2S2O3是重要的化工原料。从“价—类”角度分析(S采用平均化合价),下列制备Na2S2O3的方案理论上可行的是(填字母)。
a.
 b.
b.
c.
 d.
d.
-
(5) 已知中学常见化合物E能被KMnO4氧化为Na2SO4 , 则
 的E溶液与
的E溶液与 的KMnO4溶液恰好反应时,Mn元素在还原产物中的化合价为;中学实验室某无色盐溶液可能混入了E和Na2SO4中的一种或二种,判断是否混入杂质的最合理的可靠的实验操作:取试样于试管中,依次加入下列试剂(填试剂序号)即可确认。
的KMnO4溶液恰好反应时,Mn元素在还原产物中的化合价为;中学实验室某无色盐溶液可能混入了E和Na2SO4中的一种或二种,判断是否混入杂质的最合理的可靠的实验操作:取试样于试管中,依次加入下列试剂(填试剂序号)即可确认。①Ba(NO3)2溶液 ②BaCl2溶液 ③稀盐酸 ④稀硝酸 ⑤品红溶液 ⑥酸性KMnO4溶液
-
(6) 写出D与另外一种物质化合,一步生成F的化学方程式。



