第3节 氧化剂和还原剂 知识点题库
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中Fe3+还原成Fe2+ , 有利于人体吸收.
-
(1) 在人体中进行Fe2+
 Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂.
Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂.
-
(2) “服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作剂.
-
(3) 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(HCl)的作用下转化成亚铁盐,此反应的离子方程式为.
已知氯气和NaOH在一定温度下能发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,3Cl2+6NaOH=5NaCl+NaClO3+3H2O.某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO,NaClO3的混合溶液.经测定ClO﹣与ClO3﹣的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A . 21:5
B . 11:3
C . 3:1
D . 4:1
用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后驾车.反应的化学方程式如下:2CrO3+3C2H5OH+3H2SO4═Cr2(SO4)3+3CH3CHO+6H2O此反应的氧化剂是( )
A . H2SO4
B . CrO3
C . Cr2(SO4)3
D . C2H5OH
某溶液中含有的溶质是FeBr2、FeI2 , 若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色(已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀),则下列叙述正确的是( )
A . 原溶液中的Br﹣一定被氧化
B . 通入氯气之后原溶液中的Fe2+一定被氧化
C . 溶液中一定不存在Fe2+
D . 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,能产生黄色沉淀
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
KMnO4+HCl(浓)═KCl+MnCl2+Cl2↑+H2O
-
(1) 配平该化学方程式:KMnO4+HCl(浓)═KCl+MnCl2+Cl2↑+H2O
-
(2) 该反应中,氧化剂是;氧化产物是
-
(3) 当有0.10mol电子发生转移时,生成氯气的体积为(标准状况),被氧化的HCl的物质的量为.
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A . 5∶3
B . 5∶2
C . 1∶1
D . 3∶5
一定能实现铁元素之间相互转化的措施是( )

A . 实现①的转化,用比铁活泼的金属
B . 实现②的转化,通过钢铁电化腐蚀
C . 实现③的转化,加入少量稀硝酸
D . 实现④的转化,加入过量氯气
某稀溶液中含有4 mol KNO3和2.5 mol H2SO4 , 向其中加入1.5 mol Fe,充分反应(已知NO  被还原为NO),最终溶液体积为1L。下列说法正确的是( )
被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A . 反应后生成NO的体积为33.6 L (标况)
B . 所得溶液中c(Fe2+)∶c(Fe3+)=1∶2
C . 所得溶液中c(NO  )=2.75 mol·L-1
D . 所得溶液中的溶质只有FeSO4
)=2.75 mol·L-1
D . 所得溶液中的溶质只有FeSO4
我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”;②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是( )
A . ①中描述的化学反应是可逆反应
B . “曾青”是含有Cu2+的溶液,如硫酸铜溶液
C . “积变又还成丹砂”中的“还”可理解为“被还原”
D . 水银能跟曾青发生置换反应生成单质铜
下列变化必须加入还原剂才能实现的是( )
A . KClO3→KCl
B . Fe3+→Fe2+
C . HCO3- →CO32-
D . Cu→Cu2+
高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3 +4NaOH
+3NaClO=2Na2FeO4+3NaCl +5H2O
-
(1) 用单线桥在方程式中标出电子转移的情况:;
-
(2) Na2FeO4中铁元素的化合价是价,Na2FeO4具有较强的(填“氧化性”或“还原性”)
-
(3) 实验室欲配制250mL0.1 mol•L-1NaOH溶液,除烧杯、玻璃棒、量筒、胶头滴管,还需要用到的玻璃仪器为,下列操作配制的溶液浓度偏低的是;
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线
-
(4) 在容量瓶的使用方法中,下列操作正确的是___。A . 容量瓶用水洗净后,再用待配溶液洗涤 B . 使用容量瓶前检验是否漏水 C . 定容后,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。 D . 配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线下1~2cm处,用胶头滴管加蒸馏水至刻度线。
硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2 , 用Cu与稀HNO3反应制取NO。
-
(1) 请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目
-
(2) 64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是(填字母代号)。
A.0.5mol B.1.0mol C.2.0mol D.3.0mol
产生的气体分别是,其物质的量之比是
-
(3) 实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。HNO3+→ + + NO↑+H2O
-
(4) 硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是_______(填字母代号)。A . Cu
 Cu(NO3)2
B . Cu
Cu(NO3)2
B . Cu  CuO
CuO  Cu(NO3)2
C . Cu
Cu(NO3)2
C . Cu  CuO
CuO  Cu(OH)2
Cu(OH)2  Cu(NO3)2
D . Cu
Cu(NO3)2
D . Cu  CuSO4
CuSO4  Cu(NO3)2
Cu(NO3)2
北京市场销售的某种食用精制盐包装袋上有如下说明:

-
(1) 碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O
-
(2) 上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
-
(3) 已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg。
C和CuO在高温下反应可能生成Cu、  、
、  、CO。现将
、CO。现将 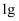 碳粉跟
碳粉跟  混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为
混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为  ,残余气体在标准状况下的体积为
,残余气体在标准状况下的体积为  。下列说法错误的是( )
。下列说法错误的是( )
 、
、  、CO。现将
、CO。现将 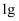 碳粉跟
碳粉跟  混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为
混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为  ,残余气体在标准状况下的体积为
,残余气体在标准状况下的体积为  。下列说法错误的是( )
。下列说法错误的是( )
A . 在硬质试管中隔绝空气高温加热固体混合物时,有 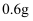 碳参加了反应
B . 试管中发生的所有氧化还原反应共转移电子
碳参加了反应
B . 试管中发生的所有氧化还原反应共转移电子  C . 反应后试管中剩余的固体混合物的总质量为
C . 反应后试管中剩余的固体混合物的总质量为  D . 反应生成铜和氧化亚铜的总物质的量为
D . 反应生成铜和氧化亚铜的总物质的量为 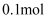
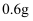 碳参加了反应
B . 试管中发生的所有氧化还原反应共转移电子
碳参加了反应
B . 试管中发生的所有氧化还原反应共转移电子  C . 反应后试管中剩余的固体混合物的总质量为
C . 反应后试管中剩余的固体混合物的总质量为  D . 反应生成铜和氧化亚铜的总物质的量为
D . 反应生成铜和氧化亚铜的总物质的量为 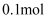
下列关于有关物质的叙述正确的是 ( )
A . 物质所含元素处于最高价态一定具有强氧化性
B . 可以利用金属活动性顺序表判断金属单质的还原性
C . 氧化还原反应的本质是电子的得失
D . 金属单质可以被氧化,也可以被还原
将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47
g,试分析
-
(1) 负极电极反应式正极电极反应式
-
(2) 计算:①产生氢气的体积L(标准状况);②通过导线的电子有 mol
下列反应中  作为氧化剂的是( )
作为氧化剂的是( )
 作为氧化剂的是( )
作为氧化剂的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
价带即为价电子占据的能带,价带失去电子产生有强氧化性的空穴,价带的能量低于导带。下图是利用光催化氧化技术生成HO•降解物的原理示意图。下列说法错误的是( )
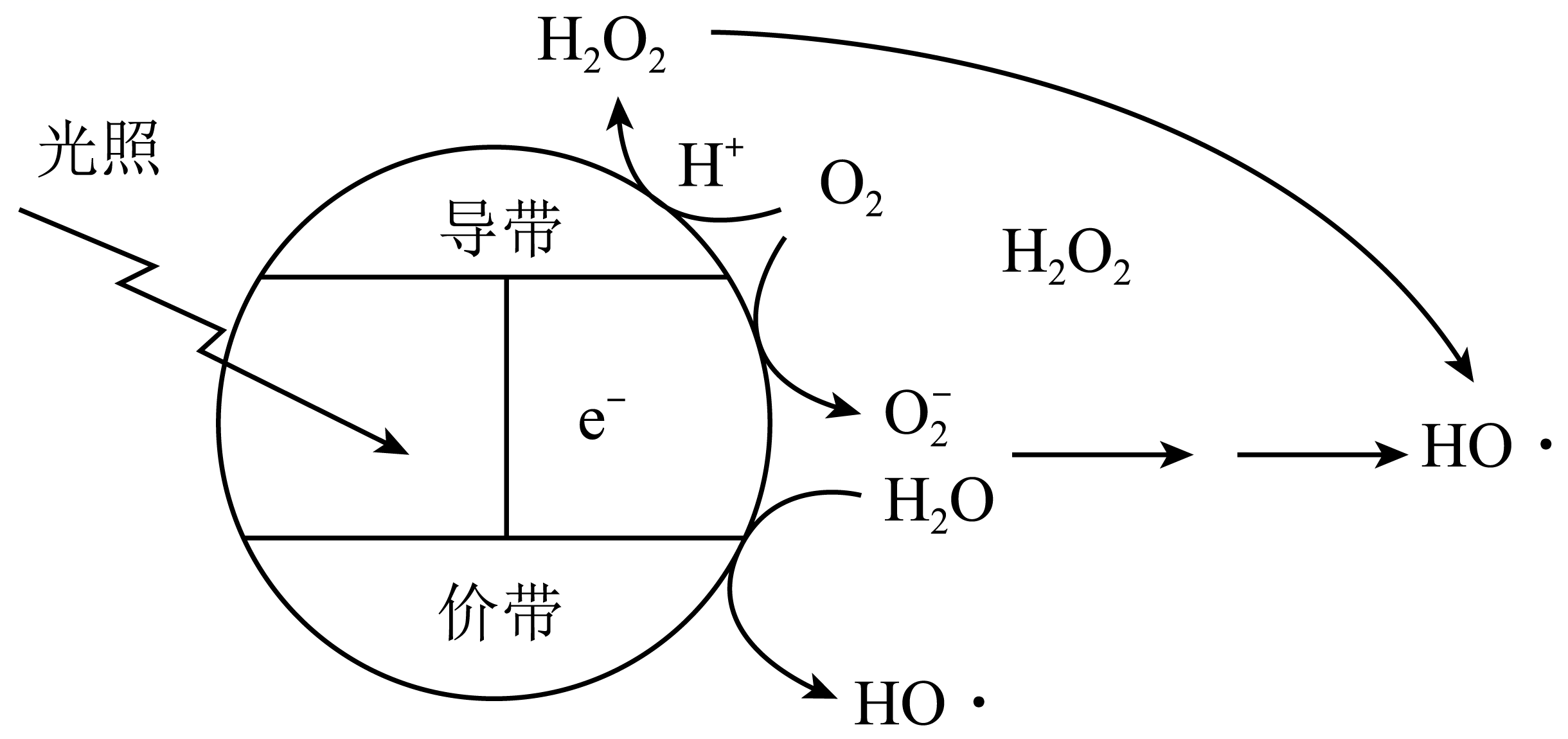
A . 图示中,光能最终转化为化学能
B . O2在导带上发生还原反应
C . H2O在价带上发生的电极反应为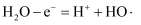 D . 电子从导带流向价带
D . 电子从导带流向价带
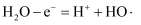 D . 电子从导带流向价带
D . 电子从导带流向价带
中国疾控中心指出,消毒是疫情防控的重要措施。含氯消毒剂是一种高效、安全的杀菌消毒剂。
-
(1) 84消毒液是一种家庭常用消毒剂,但与洁厕灵(主要成分为盐酸)混合使用,混合时会产生黄绿色的有毒气体,其反应的离子方程式为。
-
(2)
 是国际上公认的高效、安全的杀菌消毒剂。工业制备
是国际上公认的高效、安全的杀菌消毒剂。工业制备 的反应原理为:
的反应原理为: , X的化学式为,每生成1mol
, X的化学式为,每生成1mol , 反应中转移电子mol。在进行饮用水消毒时,
, 反应中转移电子mol。在进行饮用水消毒时, 可转化为
可转化为 , 1mol
, 1mol 与g(保留两位小数)NaClO氧化消毒能力相当(用得电子数目多少衡量氧化消毒能力强弱)。
与g(保留两位小数)NaClO氧化消毒能力相当(用得电子数目多少衡量氧化消毒能力强弱)。
精炼铜工业中阳极泥的综合利用具有重要意义,从中间产品分金渣(主要成分为: 、
、 、
、 、
、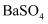 )中获取高纯银的流程如下图所示。下列说法错误的是( )
)中获取高纯银的流程如下图所示。下列说法错误的是( )
 、
、 、
、 、
、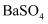 )中获取高纯银的流程如下图所示。下列说法错误的是( )
)中获取高纯银的流程如下图所示。下列说法错误的是( )
已知:在上述反应的温度下
① ,
,  ;
;
② 。
。
A . “分银”时 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为 , 该反应的化学平衡常数为
, 该反应的化学平衡常数为 B . “分银渣”的主要成分为
B . “分银渣”的主要成分为 C . “沉银”时为防止产生污染性有毒气体,盐酸不宜过量
D . 若“还原”时有
C . “沉银”时为防止产生污染性有毒气体,盐酸不宜过量
D . 若“还原”时有 生成,则该反应中氧化剂与还原剂的物质的量之比为
生成,则该反应中氧化剂与还原剂的物质的量之比为
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为 , 该反应的化学平衡常数为
, 该反应的化学平衡常数为 B . “分银渣”的主要成分为
B . “分银渣”的主要成分为 C . “沉银”时为防止产生污染性有毒气体,盐酸不宜过量
D . 若“还原”时有
C . “沉银”时为防止产生污染性有毒气体,盐酸不宜过量
D . 若“还原”时有 生成,则该反应中氧化剂与还原剂的物质的量之比为
生成,则该反应中氧化剂与还原剂的物质的量之比为
最近更新



