第3节 氧化剂和还原剂 知识点题库
将一定量的锌与100mL 18.5mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L,则下列叙述中错误的是( )
A . 反应中消耗的Zn的质量为97.5 g
B . 气体A中SO2和H2的体积比为1:4
C . 反应中被还原的元素只有一种
D . 反应中共转移电子3 mol
根据所学知识完成题目:
-
(1) 用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
-
(2) 钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂 mol,有 mol电子发生转移,相当于测出含钙元素的质量是 g.
在一定条件下,下列选项中括号内的物质能被完全消耗的是( )
A . 常温下将64g铜片投人过量浓硫酸中(铜片)
B . 向含有0.2molBa(OH)2和0.1molNaOH的混合溶液中通入标况下3.36LCO2(CO2)
C . 向l0mL3mol•L﹣1的盐酸中加入5.6g铁(铁)
D . 向5.5gMnO2粉末中加入20mL2mol•L﹣1双氧水(MnO2)
Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分.铜的冶炼过程通常发生反应:Cu2S+Cu2O=6Cu+SO2↑,下列有关说法正确的是( )
A . 该反应中有三种元素的化合价发生了变化
B . 每生成0.1mol Cu,转移0.2 mol 电子
C . Cu2S在反应中既是氧化剂又是还原剂
D . Cu既是氧化产物又是还原产物
下列反应中,一定不属于氧化还原反应的是( )
A . 化合反应
B . 分解反应
C . 置换反应
D . 复分解反应
工业上以软锰矿(主要成分为MnO2) 为主要原料制备高锰酸钾(KMnO4)的工艺流程如下:

回答下列问题:
-
(1) 原料软锰矿在使用之前通常需粉碎,其目的是。
-
(2) “烘炒”时是将混合物放入某种材质的坩埚内,混合均匀,小火加热至熔融,有K2MnO4和KCl生成,则烘炒过程中发生反应的化学方程式为;“烘炒”时所用坩埚的材质可以选用(填字母)。
a.石英
b.氧化铝
c.硅酸盐陶瓷
d.铁
-
(3) 已知水溶过程中无化学反应发生,通入CO2使反应体系呈中性或弱酸性即可发生歧化反应,则歧化时发生反应的氧化产物与还原产物的物质的量之比为。
-
(4) 对滤液进行蒸发浓缩时,温度不宜超过60℃,其原因是;将蒸发温度控制在60℃左右的最佳操作方法是。
-
(5) 流程中可以循环利用的物质是。
-
(6) 用CO2歧化法将K2MnO4转化为KMnO4属于传统工艺,现代工艺多采用电解法,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为;与“CO2歧化法”相比,“电解法”的显著优点是。
下列转化中,需要加入适当的还原剂才能实现的是( )
A . PCl3→PCl5
B . MnO4-→Mn2+
C . SO3→SO42-
D . CO2→H2CO3
硫代硫酸钠可作为脱氯剂,已知25.0mL0.100mol•L-1Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A . S2-
B . S
C . SO32-
D . SO42-
已知有下图所示物质相互转换关系
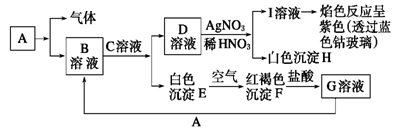
试回答:
-
(1) 写出B的化学式,D的化学式;
-
(2) 写出由E转变成F的化学方程式;
-
(3) 向G溶液中加入A的离子方程式;向G溶液中加入铜片的离子方程式;
-
(4) 简述B溶液中阳离子的检验方法。
下列实验中的颜色变化,与氧化还原反应无关的是( )
| 选项 | A | B | C | D |
| 实验 | 将CuSO4溶液中加入淀粉KI溶液 | 将过氧化钠加入石蕊溶液中 | 将Na2S2O3溶液滴入FeCl3溶液中 | 将Cu(NO3)2溶液滴入Mg(OH)2浊液中 |
| 现象 | 产生白色沉淀,溶液变蓝色 | 溶液变蓝,随后逐渐褪色 | 产生淡黄色沉淀,溶液由黄色逐渐变为浅绿色 | 沉淀由白色逐渐变为蓝色 |
A . A
B . B
C . C
D . D
分类法在化学发展中起到了非常重要的作用,下列分类标准合理的是( )
A . 根据是否含有氧元素,将物质分为氧化剂和还原剂
B . 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
C . 根据水溶液是否能够导电,将物质分为电解质和非电解质
D . 根据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br-②2Br+Cl2=Br2+2Cl-③2Fe3++2I-=2Fe2++I2 . 由此判断下列说法正确的是( )
A . 铁元素在反应①中被还原,在③中被氧化
B . 反应②中当有1个Cl2被氧化时,有2个Br-被还原
C . 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+
D . 还原性强弱顺序为:I->Fe2+>Br->Cl-
研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物—光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )

A . 整个过程中O3作催化剂
B . 反应Ⅲ的方程式为O2+O=O3
C . 光化学烟雾中含甲醛、乙醛等刺激性物质
D . 反应Ⅰ、反应Ⅱ均属于氧化还原反应
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、  、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
 、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( ) 
A . 还原剂是含CN-的物质,氧化产物只有N2
B . 氧化剂是ClO- , 还原产物是  C . 配平后氧化剂与还原剂的化学计量数之比为4∶1
D . ClO-发生还原反应,表现出氧化性
C . 配平后氧化剂与还原剂的化学计量数之比为4∶1
D . ClO-发生还原反应,表现出氧化性
 C . 配平后氧化剂与还原剂的化学计量数之比为4∶1
D . ClO-发生还原反应,表现出氧化性
C . 配平后氧化剂与还原剂的化学计量数之比为4∶1
D . ClO-发生还原反应,表现出氧化性
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 , 请根据要求回答下列问题:
-
(1) 反应过程中,被氧化与被还原的元素的物质的量之比为。
-
(2) 写出该反应的化学方程式,并标出电子转移的方向和数目:。若反应中生成0.2molHNO3 , 转移的电子数为个。
-
(3) NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是(写出2点)、。
-
(4) 一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有(填化学式)。
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):

下列说法错误的是( )
A . Na2S2O4中S元素的化合价为+3
B . 装置II生成4 mol H+ , 消耗36 g水
C . 装置IV获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤
D . 装置III用甲烷燃料电池进行电解,当消耗24 g甲烷时,理论上可再生10 mol Ce4+
反应 3SiO2+2N2+6C  Si3N4+6CO 中的氧化剂是( )
Si3N4+6CO 中的氧化剂是( )
 Si3N4+6CO 中的氧化剂是( )
Si3N4+6CO 中的氧化剂是( )
A . SiO2
B . N2
C . C
D . SiO2 和N2
钒具有广泛用途,利用含钒废催化剂(主要含有  、
、 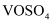 和不溶性硅酸盐)制备
和不溶性硅酸盐)制备  的新工艺流程如图:
的新工艺流程如图:
 、
、 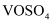 和不溶性硅酸盐)制备
和不溶性硅酸盐)制备  的新工艺流程如图:
的新工艺流程如图: 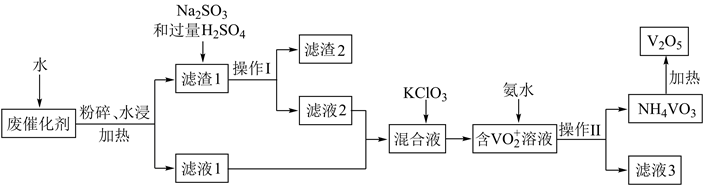
已知:滤液1和滤液2中钒以  的形式存在。回答下列问题:
的形式存在。回答下列问题:
-
(1) 在实验室中操作Ⅰ用到的玻璃仪器有。
-
(2) 在滤渣1中加入
 和过量
和过量  溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为。
溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为。
-
(3) 混合溶液中加入
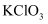 ,发生反应的离子方程式是。
,发生反应的离子方程式是。
-
(4) 钒最后以
 的形式沉淀出来。沉钒率(
的形式沉淀出来。沉钒率(  沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是(写一条即可)。
沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是(写一条即可)。 
-
(5) 称取w g所得产品,先用硫酸溶解,得到
 溶液,再加入
溶液,再加入  的
的  溶液,最后用
溶液,最后用  酸性
酸性  溶液滴定过量的
溶液滴定过量的  至终点,消耗溶液
至终点,消耗溶液  的体积为
的体积为  。假设杂质不参与反应,锰被还原为
。假设杂质不参与反应,锰被还原为  。则产品中
。则产品中  的质量分数为,(已知
的质量分数为,(已知  和
和  溶液反应的离子方程式为
溶液反应的离子方程式为 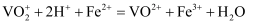 )
)
关于反应 , 下列说法正确的是( )
, 下列说法正确的是( )
 , 下列说法正确的是( )
, 下列说法正确的是( )
A .  是氧化剂,发生氧化反应
B .
是氧化剂,发生氧化反应
B .  是还原剂,只表现还原性
C . 反应生成18g水时,转移1.2mol电子
D . 还原性:
是还原剂,只表现还原性
C . 反应生成18g水时,转移1.2mol电子
D . 还原性:
 是氧化剂,发生氧化反应
B .
是氧化剂,发生氧化反应
B .  是还原剂,只表现还原性
C . 反应生成18g水时,转移1.2mol电子
D . 还原性:
是还原剂,只表现还原性
C . 反应生成18g水时,转移1.2mol电子
D . 还原性:
 中,关于该反应的说法正确的是( )
中,关于该反应的说法正确的是( )
A . 该反应中氧化剂与还原剂的质量比为2:1
B . 若69g 参加反应,转移的电子数为
参加反应,转移的电子数为 个
C .
个
C .  只作氧化剂
D .
只作氧化剂
D .  是还原剂
是还原剂
 参加反应,转移的电子数为
参加反应,转移的电子数为 个
C .
个
C .  只作氧化剂
D .
只作氧化剂
D .  是还原剂
是还原剂
最近更新



