1.2 原子结构和相对原子质量 知识点题库
下列各组粒子中属于同位素的是( )
A . 16O和18O
B . H2O和D2O
C . H2和D2
D . 24Mg和24Na
下列叙述正确的是( )
A . 40K和40Ca原子中的质子数和中子数都相等
B . 某元素原子最外层只有两个电子,它一定是金属元素
C . 任何原子或离子的组成中都含有质子
D . 同位素的不同核素物理、化学性质完全相同
在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为( )
A . 30
B . 12
C . 17
D . 20
下列叙述错误的是( )
A . 13C和14C属于同一种元素,它们互为同位素
B . 1H和2H是不同的核素,它们的质子数相等
C . 14C和14N的质量数相等,它们的中子数不等
D . 6Li和7Li的电子数相等,中子数也相等
2007年10月24日,我国成功发射了“嫦娥一号”月球探测火箭,其主要任务之一是评估月球上土壤的厚度和3He的资源量,以下关于3He的说法正确的是( )
A . 是4He的同素异形体
B . 比4He多一个中子
C . 是4He的同位素
D . 3He代表原子核内有2个质子和3个中子的氦原子
核外电子数相等的原子一定是( )
①同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤互为同位素.
A . ①②③
B . ①③⑤
C . ①②③④
D . 全部
下列说法中正确的是( )
A . 3p2表示3p能级有两个轨道
B . 同一原子中,1s、2s、3s电子能量逐渐减小
C . 处于最低能量的原子叫做基态原子
D . 同一原子中,2p、3p、4p能级的轨道数依次增多
磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
-
(1) 基态铜原子的电子排布式为;价电子中成对电子数有个。
-
(2) 磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由:。
-
(3) 磷青铜中的锡、磷两元素电负性的大小为SnP(填“>”“<”或“=”)。
-
(4) 某磷青铜晶胞结构如图所示。
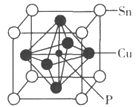
①则其化学式为。
②该晶体中距离Cu原子最近的Sn原子有个,这些Sn原子所呈现的构型为。
③若晶体密度为8.82g·cm-3 , 最近的Cu原子核间距为pm(用含NA的代数式表示)。
前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5 , B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
-
(1) D元素基态原子的价电子排布式为.
-
(2) B、X、D氢化物的沸点由高到低的顺序为(用相应的化学式作答).
-
(3) E元素是A元素所在周期中电负性最大的,则EO3-的立体构型为.
-
(4) F元素基态原子M层上有5对成对电子,F元素的名称为.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为,δ、γ、α三种晶胞的密度之比为.

13C﹣NMR(核磁共振)、15N﹣NMR 可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wuthrich 等人为此获得 2002 年诺贝尔化学奖.下面有关 13C、15N 叙述正确的是( )
A . 13C 与 15N 有相同的中子数
B . 13C 与 12C 是同一种核素
C . 15N2 与 14N2 互为同位素
D . 13C60 与金刚石互为同素异形体
下列化学用语使用正确的是( )
A . 氯化镁的电子式:  B . S2-的结构式示意图:
B . S2-的结构式示意图:  C . 质子数为8,中子数为10的核素:
C . 质子数为8,中子数为10的核素:  D . CO2分子式的结构式:O-C-O
D . CO2分子式的结构式:O-C-O
 D . CO2分子式的结构式:O-C-O
D . CO2分子式的结构式:O-C-O
德国重离子研究中心人工合成的第 112 号元素的正式名称为“Copernicium”,相应的元素符号为“Cn” 。该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成 Cn的过程可表示为:7030Zn+20882Pb=22782Cn+10n下列叙述中正确的是( )
A . 上述合成过程属于化学变化
B . Cn 元素的相对原子质量为 277
C . 22782Cn的原子核内中子数比质子数多 53
D . Cn 元素位于元素周期表的第六周期,是副族元素
某  元素天然存在的一个原子中共有质子、中子、电子93个,其中35个粒子不带电,则该原子的相对原子质量约为( )
元素天然存在的一个原子中共有质子、中子、电子93个,其中35个粒子不带电,则该原子的相对原子质量约为( )
 元素天然存在的一个原子中共有质子、中子、电子93个,其中35个粒子不带电,则该原子的相对原子质量约为( )
元素天然存在的一个原子中共有质子、中子、电子93个,其中35个粒子不带电,则该原子的相对原子质量约为( )
A . 58
B . 64
C . 35
D . 30
下列说法正确的是( )
A . BF3和NCl3中,每个原子的最外层都具有8电子稳定结构
B . 金刚石和石英晶体的熔点差别大的主要原因是共价键键长不同
C . NaOH熔化的过程中,既破坏了离子键又破坏了共价键
D . 常温常压下,H2O是液态,H2S是气态,说明H2O的热稳定性更好
南京理工大学团队成功合成了能在室温下稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N  是制备全氮类物质N
是制备全氮类物质N  N
N  的重要中间体。下列说法正确的是( )
的重要中间体。下列说法正确的是( )
 是制备全氮类物质N
是制备全氮类物质N  N
N  的重要中间体。下列说法正确的是( )
的重要中间体。下列说法正确的是( )
A . (N5)6(H3O)3(NH4)4Cl中含有共价键,属于共价化合物
B . (N5)6(H3O)3(NH4)4Cl中的H3O+与NH  含有的电子数不相同
C . 1molN
含有的电子数不相同
C . 1molN  N
N  中含有70mol电子,N
中含有70mol电子,N  N
N  与N2属于同素异形体
D . N
与N2属于同素异形体
D . N  N
N  中含有共价键和离子键,属于离子化合物
中含有共价键和离子键,属于离子化合物
 含有的电子数不相同
C . 1molN
含有的电子数不相同
C . 1molN  N
N  中含有70mol电子,N
中含有70mol电子,N  N
N  与N2属于同素异形体
D . N
与N2属于同素异形体
D . N  N
N  中含有共价键和离子键,属于离子化合物
中含有共价键和离子键,属于离子化合物
4种短周期主族元素X、Y、Z和Q的原子序数依次增大。相关信息如下表:
| 元素 | 相关信息 |
| X | 同周期的主族元素中,X原子的半径最大 |
| Y | 气态氢化物与最高价氧化物对应水化物能发生化合反应 |
| Z | 原子的电子层数为 |
| Q | 原子的最外层电子数是内层电子数的一半 |
下列说法正确的是( )
A . X、Z的最高正价之和等于8
B . 元素的非金属性:  C . 化合物
C . 化合物  、
、  中各粒子的最外层均达到
中各粒子的最外层均达到  结构
D . 与Z同主族且位于第7周期的元素的单质预测是白色固体
结构
D . 与Z同主族且位于第7周期的元素的单质预测是白色固体
 C . 化合物
C . 化合物  、
、  中各粒子的最外层均达到
中各粒子的最外层均达到  结构
D . 与Z同主族且位于第7周期的元素的单质预测是白色固体
结构
D . 与Z同主族且位于第7周期的元素的单质预测是白色固体
含氯消毒剂是新冠肺炎疫情期间防疫的一种重要消毒剂,下列说法正确的是( )
A . 用电子式表示HCl的形成过程:  B . 次氯酸能杀菌消毒,是因为次氯酸具有强氧化性
C . 氯离子的结构示意图
B . 次氯酸能杀菌消毒,是因为次氯酸具有强氧化性
C . 氯离子的结构示意图  D .
D .  Cl这种核素的原子中有17个中子
Cl这种核素的原子中有17个中子
 D .
D .  Cl这种核素的原子中有17个中子
Cl这种核素的原子中有17个中子
下列说法正确的是( )
A .  与
与  互为同分异构体
B . 乙二醇和甘油互为同系物
C .
互为同分异构体
B . 乙二醇和甘油互为同系物
C .  和
和  是同一种物质
D .
是同一种物质
D .  、
、  、
、  、
、  是不同的核素,可以形成4种不同的水分子
是不同的核素,可以形成4种不同的水分子
 与
与  互为同分异构体
B . 乙二醇和甘油互为同系物
C .
互为同分异构体
B . 乙二醇和甘油互为同系物
C .  和
和  是同一种物质
D .
是同一种物质
D .  、
、  、
、  、
、  是不同的核素,可以形成4种不同的水分子
是不同的核素,可以形成4种不同的水分子
我国中医古籍《玉楸药解》中记载:“胆矾味酸,性寒,入手太阴肺经。降逆止嗽,消肿化积。”胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图为:

下列有关说法正确的是( )
A . 基态Cu2+的价层电子排布式为3d84s1
B . 硫原子采取sp3杂化,其价层电子对数为3
C . 胆矾中微粒间作用力包括离子键、极性键、配位键和氢键
D . 电负性:H<Cu<O<S
2022年2月4日,万众瞩目的第24届冬奥会在北京隆重开幕,本届冬奥会尽显化学高科技。下列有关说法错误的是( )
A . 冬奥会采用氢能源保障车有利于“碳达峰、碳中和”
B . 冬奥礼仪服装“战袍”可以利用微信小程序,调控石墨烯片加热保暖。石墨烯和碳纳米管互为同分异构体
C . 国家速滑馆采用的硫化镉发电玻璃,可将太阳能转化为电能
D . “飞扬”火炬喷口外壳采用聚硅氮烷树脂,该树脂属于无机聚合物
最近更新
 ,最外层电子数为
,最外层电子数为 



