1.2 原子结构和相对原子质量 知识点题库
下列说法中不正确的是( )
A . O2与O3互为同素异形体
B . 16O与18O核外电子排布不同
C . 麦芽糖与蔗糖互为同分异构体
D . CH3CH3与  互为同系物
互为同系物
下列原子中未成对电子(单独占据1个原子轨道的电子)数为2的是( )
A . O
B . N
C . Cu
D . F
月球上含有丰富的  He,关于
He,关于  He的说法错误的是( )
He的说法错误的是( )
 He,关于
He,关于  He的说法错误的是( )
He的说法错误的是( )
A . 是一种核素
B . 原子核内有1个中子
C . 与  He互为同位素
D . 比
He互为同位素
D . 比  He少一个电子
He少一个电子
 He互为同位素
D . 比
He互为同位素
D . 比  He少一个电子
He少一个电子
原子序数依次递增的A、B、C、D、E五种元素,其中只有E是第四周期元素,A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
-
(1) E的+2价离子基态核外电子排布式为。
-
(2) A,B,C,D原子中,电负性最大的是(填元素符号)。
-
(3) 1mol B2A4分子中σ键的数目为。B4A6为链状结构,其分子中B原子轨道的杂化类型只有一种,则杂化类型为。
-
(4) 元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子空间构型为。
-
(5) E和C形成的一种化合物的晶胞结构如图所示,该化合物的化学式为。

X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
-
(1) R元素在周期表中的位置是,其基态原子的价层电子排布图为。
-
(2) 下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是(填标号)。
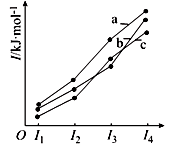
-
(3) 化合物(XH2=X=O)分子中X原子杂化轨道类型是,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为。
-
(4) Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为。
-
(5) 某R的氧化物晶胞结构如下图所示,该物质的化学式为。已知该晶体密度为ρg/cm3 , 距离最近的两个原子的距离为d pm,则R的相对原子质量为。 (阿伏加德罗常数为NA)
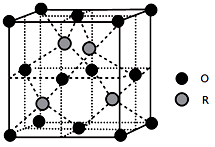
-
(6) X形成的一种常见单质,性质硬而脆,原因是。
原子序数在数值上等于()
A . 该原子的质量数
B . 原子核内中子数
C . 原子核内的质子数
D . 该元素的相对原子质量
下列叙述中,正确的是( )
A . 1s电子云界面图是一个球面,表示在这个球面以内,电子出现的概率为 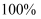 B . 在能层、能级、以及电子云的伸展方向确定时,电子的运动状态才能确定下来
C . 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
D . 原子核外的电子就像行星围绕太阳一样绕着原子核做圆周运动
B . 在能层、能级、以及电子云的伸展方向确定时,电子的运动状态才能确定下来
C . 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
D . 原子核外的电子就像行星围绕太阳一样绕着原子核做圆周运动
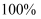 B . 在能层、能级、以及电子云的伸展方向确定时,电子的运动状态才能确定下来
C . 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
D . 原子核外的电子就像行星围绕太阳一样绕着原子核做圆周运动
B . 在能层、能级、以及电子云的伸展方向确定时,电子的运动状态才能确定下来
C . 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
D . 原子核外的电子就像行星围绕太阳一样绕着原子核做圆周运动
下列是几种原子的基态电子排布,电负性最大的原子是( )
A . 1s22s22p63s23p2
B . 1s22s22p63s23p3
C . 1s22s22p63s23p64s2
D . 1s22s22p4
下列互为同位素的是( )
A . O2与O3
B .  与
与  C . H2O与H2O2
D . CH3CH2CH3与CH3CH2CH2CH3
C . H2O与H2O2
D . CH3CH2CH3与CH3CH2CH2CH3
 与
与  C . H2O与H2O2
D . CH3CH2CH3与CH3CH2CH2CH3
C . H2O与H2O2
D . CH3CH2CH3与CH3CH2CH2CH3
我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
-
(1) C、O、Si三种元素电负性由大到小的顺序为;第一电离能I1(Si)I1(Ge)(填“>”或“<”)。
-
(2) 基态Ge原子价电子排布式为;SiO2、GeO2具有类似的晶体结构,SiO2熔点较高,其原因是
-
(3) 如图为硼酸晶体的片层结构,其中硼原子的杂化方式为。该晶体中存在的作用力有。
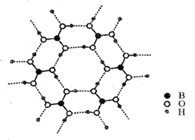
A.共价键 B.离子键 C.氢键
-
(4) Fe和Cu可分别与氧元素形成低价态氧化物FeO和Cu2O。
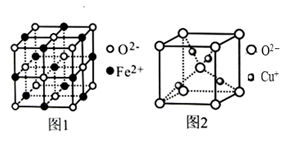
①FeO立方晶胞结构如图1所示,则Fe2+的配位数为。
②Cu2O立方晶胞结构如图2所示,若晶胞边长为acm,则该晶体的密度为g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数)
短周期主族元素W、X、Y、Z的原子序数依次增大,四种元元素组成的一种分子簇的球棍模型如图所示。W与X不在同周期,X原子的最外层电子数与核外电子总数之比为3:4,Z的周期数等于族序数。下列说法错误的是( )

A . 该分子簇的化学式为Y2Z2X6W2
B . 工业上常用电解熔融YX制备Y单质
C . 简单离子的半径:X>Y>Z
D . Y、Z的简单离子均可促进水的电离
有X、Y、Z三种元素,它们的原子序数都小于20,对应离子X+、Y2-、Z-具有相同的电子层结构。有关描述中正确的是( )
A . 原子序数:Z>X>Y
B . 还原性:Z->Y2-
C . Z元素最高价为+7
D . X与Y可形成X2Y2化合物
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A . Y原子的价层电子排布式为3s23p5
B . 稳定性:Y的氢化物>Z的氢化物
C . 第一电离能:Y<Z
D . X、Y两元素形成的化合物为离子化合物
硒(34Se)是人体必需的微量元素,它能有效提高人体免疫机能,抑制癌症和心脑血管等疾病的发病率,下列有关说法错误的是( )
A . 硒元素位于元素周期表中第15列
B . 基态硒元素原子核外电子所占据的最高能级的电子云轮廓图为哑铃形
C . 硒的最高价氧化物对应的水化物的化学式为H2SeO4
D . O和Se均为p区非金属元素
X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与水反应后溶液能使酚酞试液变为浅红色,X、W为同一主族元素,Y是地壳中含量最高的元素。甲、乙、丙分别为X、Z、W形成的最高价氧化物。下列判断错误的是( )

A . W位于元素周期表第三周期ⅣA族
B . 原子半径:r(Z)˃r(W)>r(Y)>r(X)
C . 丁为CO,反应③为工业制粗硅的原理
D . X、W简单氢化物的沸点: X < W
2019年诺贝尔化学奖授予约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰等三位科学家,以表彰他们在锂电池研究作出的卓越贡献。常用的锂电池用镍钴锰酸锂Li(NiCoMn)O2或磷酸铁锂(LiFePO4)等为正极材料。请回答下列问题:
-
(1) Ni在元素周期表的位置是区(填分区),基态Fe原子的价电子排布式为。
-
(2) 1 mol配合物[Co(NH3)4Cl2]Cl含σ键数目为NA。
-
(3) 磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3 , 这四种酸中酸性最强的是,HPO3中心原子的杂化方式是,写出与PO
 互为等电子体的离子(写离子符号,任写两个)。
互为等电子体的离子(写离子符号,任写两个)。
-
(4) 硫化锂 Li2S 的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若a处微粒的坐标是
 则b处微粒的坐标是;S2-的配位数是;若硫化锂晶体的密度为ρ g·cm-3 , 则Li+与S2- 的最短距离是nm(用含ρ、NA的计算式表示)。
则b处微粒的坐标是;S2-的配位数是;若硫化锂晶体的密度为ρ g·cm-3 , 则Li+与S2- 的最短距离是nm(用含ρ、NA的计算式表示)。 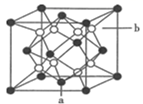
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。回答下列问题:
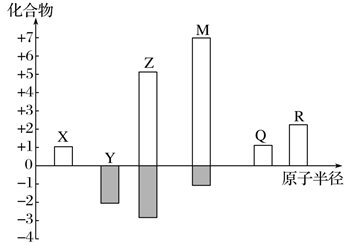
-
(1) Q元素位于元素周期表的第周期,Y元素原子最外层电子数为。
-
(2) X与Z元素所形成的常见原子团的电子式为;M与Q两种元素的最高价氧化物对应的水化物,发生反应生成盐的化学式为。
-
(3) M和R元素的简单离子的半径大小关系为(用离子符号表示)。利用中学现有基础知识,能否判断Q和R简单离子半径的大小关系(填“能”或“不能”)。M的单质与R的最高价氧化物的水化物反应的化学方程式为。
下列说法正确的是( )
A .  、
、  、
、 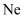 的核外电子排布相同,所以化学性质相同
B . 稳定性
的核外电子排布相同,所以化学性质相同
B . 稳定性  ,是因为水分子间存在氢键
C . 石墨转化为金刚石既有共价键的断裂和形成,也有分子间作用力的破坏
D . 在
,是因为水分子间存在氢键
C . 石墨转化为金刚石既有共价键的断裂和形成,也有分子间作用力的破坏
D . 在  、
、  、
、  的分子中,原子周围都达到了8电子稳定结构
的分子中,原子周围都达到了8电子稳定结构
 、
、  、
、 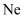 的核外电子排布相同,所以化学性质相同
B . 稳定性
的核外电子排布相同,所以化学性质相同
B . 稳定性  ,是因为水分子间存在氢键
C . 石墨转化为金刚石既有共价键的断裂和形成,也有分子间作用力的破坏
D . 在
,是因为水分子间存在氢键
C . 石墨转化为金刚石既有共价键的断裂和形成,也有分子间作用力的破坏
D . 在  、
、  、
、  的分子中,原子周围都达到了8电子稳定结构
的分子中,原子周围都达到了8电子稳定结构
现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是( )
①1s22s2p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
A . 第一电离能:④>③>①>②
B . 原子半径:②>①>③>④
C . 电负性:④>①>③>②
D . 最高正化合价:④>③=②>①
三草酸合铁酸钾  是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解:
 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解:  。回答下列问题:
。回答下列问题:
-
(1) 基态
 原子的电子排布式为,基态
原子的电子排布式为,基态  与
与  中未成对电子的数目之比为。
中未成对电子的数目之比为。
-
(2) 三草酸合铁酸钾所含元素中,第一电离能最大的是(填元素符号,下同),电负性最大的是。
-
(3) 1个
 与1个
与1个  分子中
分子中 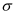 键数目之比为,
键数目之比为,  分子的立体构型为。
分子的立体构型为。
-
(4) 金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。
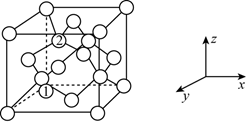
若图中原子1的坐标为
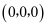 ,则原子2的坐标为。
,则原子2的坐标为。
最近更新



