1.2 原子结构和相对原子质量 知识点题库
金属元素在自然界中分布很广,其中铜等在生产生活中有着广泛的应用.

-
(1) 科学家通过X射线推测胆矾结构示意图如图1所示,
①写出基态Cu原子的核外电子排布式;金属铜采用下列(填字母代号)堆积方式

②胆矾中含有的微粒间作用力有(填字母代号).
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
③铜离子形成胆矾中配离子的离子方程式为:;
-
(2) 合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac﹣表示CH3COO﹣),其反应是:[Cu(NH3)2]Ac+CO+NH3⇌[Cu(NH3)3]Ac.CO[醋酸碳基三氨合铜(Ⅰ)]△H<0
①C、N、O三种元素的第一电离能由小到大的顺序为
②氨分子中N原子的杂化方式为
-
(3) 铜的化合物种类也很多,其常见价台为+1,+2价.如CuO、Cu2O、CuH等,如图2是同的一种氯化铜的晶胞结构,则它的化学式是.
用放射性同位素  S对杀虫剂进行标记,可跟踪杀虫剂的污染途径.该原子的中子数是( )
S对杀虫剂进行标记,可跟踪杀虫剂的污染途径.该原子的中子数是( )
 S对杀虫剂进行标记,可跟踪杀虫剂的污染途径.该原子的中子数是( )
S对杀虫剂进行标记,可跟踪杀虫剂的污染途径.该原子的中子数是( )
A . 16
B . 35
C . 19
D . 51
下列分子的结构中,原子的最外层电子不都满足8e﹣稳定结构的是( )
A . CO2
B . PCl3
C . CCl4
D . BF3
下列微粒中与OH﹣具有相同质子数和电子数的是( )
A . Na+
B . NH4+
C . Ne
D . F﹣
意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4 , 下列说法正确的是( )
A . O4和O2互为同位素
B . O4转化O2为物理变化
C . 18O是氧元素的一种核素,它的中子数是8
D . 同温同压下,等体积的O4气体和O2含有相同的分子数
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A . 原子核内有10个中子的氧原子:18O
B . 乙烯的结构简式:CH2CH2
C . CH4 分子的比例模型: 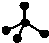 D . ﹣CH3(甲基)的电子式为:
D . ﹣CH3(甲基)的电子式为: 
经测定某微粒有与H2S拥有相同的电子数,它不可能是( )
A . HCl
B . HS﹣
C . NH2﹣
D . Ca2+
2018年1月复旦大学魏大程团队在石墨烯量子点研究领域取得重要进展。该项研究在未来光学和光电器件方面具有巨大潜力。下面有关碳的叙述正确的是( )
A . 石墨与C60互为同位素
B . 13C与14C是两种不同的原子
C . 金刚石是碳元素的一种核素
D . 14C的原子核内有2个中子
科学家于2000年合成了第116号元素(元素符号Lv).有关新质量数为293的Lv原子的描述错误的是( )
A . 质子数116
B . 中子数177
C . 电子数116
D . 该原子可表示为: 
下列说法写正确的是( )
A .  Rn+ 的质子数为 Z ,中子数为A
B . 乙烯的结构简式:CH2CH2
C . 氯化镁的电子式:
Rn+ 的质子数为 Z ,中子数为A
B . 乙烯的结构简式:CH2CH2
C . 氯化镁的电子式:  D . HClO的结构式:H-Cl-O
D . HClO的结构式:H-Cl-O
 Rn+ 的质子数为 Z ,中子数为A
B . 乙烯的结构简式:CH2CH2
C . 氯化镁的电子式:
Rn+ 的质子数为 Z ,中子数为A
B . 乙烯的结构简式:CH2CH2
C . 氯化镁的电子式:
X、Y、Z、W、Q、R 是周期表中前 36 号元素,核电荷数依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 为非金属元素,且 X 原子的核外成对电子数是未成对电子数的 2 倍,Z 的次外层电子数是最外层电子数的 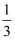 ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。
回答下列问题:
,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。
回答下列问题:
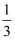 ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。
回答下列问题:
,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。
回答下列问题:
-
(1) X的最高价氧化物对应的水化物分子中,中心原子采取杂化。
-
(2) 化合物 XZ 与 Y 的单质分子互为,1mol XZ 中含有π键的数目为。
-
(3) W 的稳定离子核外有种运动状态的电子。W元素的第一电离能比其同周期 相邻元素的第一电离能高,其原因是:。
-
(4) Q 的晶体结构如图所示,则在单位晶胞中 Q 原子的个数为,晶体的配位数是。

-
(5) R元素的基态原子的核外电子排布式为;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数的数值为 NA , 则该晶体中 R 原子和 Y 原子之间的最短距离为cm。(只写计算式)

随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、  等已被发现。下列有关说法中,正确的是( )
等已被发现。下列有关说法中,正确的是( )
 等已被发现。下列有关说法中,正确的是( )
等已被发现。下列有关说法中,正确的是( )
A . H2与H3互为同位素
B . O2与O4中化学键类型相同
C . C60分子中有极性键
D .  中含有35个电子
中含有35个电子
 中含有35个电子
中含有35个电子
某原子核外电子排布为:L层电子数是K层和M层电子数之和的两倍。则该元素是( )
A . 钠
B . 镁
C . 氖
D . 氯
元素R的质量数为A,Rn一的核外电子数为x,则WgRn一所含中子的物质的量为( )
A . (A-x+n)mol
B . (A-x-n)mol
C .  mol
D .
mol
D .  mol
mol
 mol
D .
mol
D .  mol
mol
在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Co、Ni、C等多种元素。请回答:
-
(1) 基态铁的价电子排布式为,基态Ni原子的电子空间运动状态有种。
-
(2) Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是分子(填“极性”或“非极性”)。
-
(3) 实验室常用 KSCN溶液检验
 。
。 ①与KSCN中与SCN-互为等电子体的非极性分子的化学式为
②SCN-中碳原子杂化类型为。
-
(4) 配位化合物[Co(NH3)5Cl]Cl2中心原子Co的配位数为,配位原子为。1mol[Co(NH3)5Cl]Cl2中σ键mol。
-
(5) 已知Ni可以形成多种氧化物,其中一种NixO晶体的晶胞结构为NaCl型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为g·cm-3(NA 表示阿伏加德罗常数的值,只需列出表达式)。
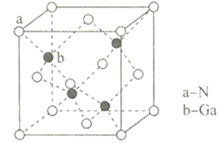
氮化镓(GaN)结构与金刚石类似,是一种半导体材料,因其具有良好的电学特性,广泛的应用于电子行业,近年智能手机的快速充电器中就使用了氮化镓材料。
-
(1) 基态N原子的电子排布式为;基态Ga原子核外电子能量最高的电子占据的能级为。
-
(2) GaN、GaP、GaAs熔点如下表所示,分析其变化原因。
晶体
GaN
GaP
GaAs
熔点/℃
1700
1480
1238
-
(3) GaN可在高温下由金属Ga和NH3反应制取。N原子和H原子可以形成多种微粒,如:NH3、NH
 、NH
、NH  、N2H4、N2H
、N2H4、N2H 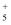 、N2H
、N2H 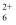 等。在N2H
等。在N2H 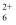 中,N原子的杂化方式为。与N2H
中,N原子的杂化方式为。与N2H 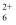 互为等电子体的物质是(写出一种);在N2H
互为等电子体的物质是(写出一种);在N2H 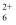 中存在的化学键类型有。
中存在的化学键类型有。 a.极性键 b.非极性键 c.离子键 d.配位键
-
(4) GaN的晶胞结构如图所示:其中与Ga原子最近的N原子所构成的空间结构为;若GaN晶体的密度为6.1 g/cm3 , 阿伏加德罗常数为NA , 则距离最近的两个N原子间的距离为nm(写出表达式即可)。
原子序数小于36的某基态原子最外层电子排布式为ns1 , 则该基态原子在元素周期表中不可能位于( )
A . 第ⅠA族
B . 第B族
C . 第Ⅷ族
D . 第ⅠB族
下列说法正确的是( )
A . 甲醇和乙二醇互为同系物
B .  与
与 互为同素异形体
C .
互为同素异形体
C .  和
和 互为同位素
D . 甘氨酸和硝基乙烷(
互为同位素
D . 甘氨酸和硝基乙烷( )互为同分异构体
)互为同分异构体
 与
与 互为同素异形体
C .
互为同素异形体
C .  和
和 互为同位素
D . 甘氨酸和硝基乙烷(
互为同位素
D . 甘氨酸和硝基乙烷( )互为同分异构体
)互为同分异构体
下列说法错误的是( )
A . 石墨晶体中层内导电性强于层间导电性
B . 基态Cr3+的最高能层中成对电子与未成对电子的数目比为8∶3
C . (CH3COO)2Ni·4H2O的空间构型为八面体,中心离子的配位数为6
D . N元素的电负性比P元素的大,可推断NCl3分子的极性比PCl3的大
钴(27Co)的常见化合价有+2、+3等,均容易形成相应配离子,如[Co(NH3)6]2+、[Co(NH3)6]3+等,已知:[Co(NH3)6]2+易被氧化为[Co(NH3)6]3+。
-
(1) 基态Co2+的电子排布式为。
[Co(NH3)6]2+脱除烟气中NO的机理如下:

-
(2) Ⅰ.活化氧气:[Co(NH3)6]2+在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。
用“☐”标识出X中体现强氧化性的基团:。
-
(3) X中含有的配位键的数目为。
-
(4) Ⅱ.配位[Co(NH3)6]2+较钴的其它配位离子易吸收NO生成[Co(NH3)5NO]2+ , 将NO由气相转入液相。溶液的pH对NO的配位脱除率的影响如图所示。

图中pH=9.75时,NO脱除率较低,其原因可能是。
-
(5) 同一pH下,随着反应的进行,NO的脱除率下降,可能原因是。
-
(6) 写出[Co(NH3)5NO2]2+在氨水中反应生成硝酸铵和亚硝酸铵的离子方程式:。
最近更新



