1.2 原子结构和相对原子质量 知识点题库
对同温同压下的两种气体12C18O和14N2的有关比较正确的是( )
A . 质量相等时所含质子数相等
B . 体积不相等时密度有可能相等
C . 体积相等时所含电子数相等
D . 原子数相等时所含中子数相等
决定元素种类的是( )
A . 质子数
B . 电子数
C . 中子数
D . 质子数和中子数
Na、Cu、Fe、Cl、O、N是常见的6种元素.
-
(1) Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为.
-
(2) 用“>”或“<”填空:
第一电离能
原子半径
稳定性
NO
CNa
NH3H2O
-
(3) 液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
-
(4) 古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目.
某元素的原子核外有三个电子层,M层的电子数是L层电子数的  ,则该元素的原子是( )
,则该元素的原子是( )
 ,则该元素的原子是( )
,则该元素的原子是( )
A . Li
B . Si
C . Al
D . K
近代化学诞生的标志是( )
A . 原子学说(1803年)
B . 元素周期律(1869年)
C . 化学元素的概念(1661年)
D . 氧化学说(1771年)
白磷是制备高纯度磷酸、烟幕弹、燃烧弹等的重要原料,工业上制备白磷的原理之一为4Ca5 (PO4)3F+21SiO2+30C⇌3P4+20GaSiO3+30CO↑+SiF4 , 回答相关问题:
-
(1) 基态磷原子的价层电子排布图为,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为(用元素符号表示).
-
(2) 上述物质中,中心原子杂化轨道类型为sp3的分子有,SiF4分子构型为.若不考虑C的晶体类型,则上述反应过程消失的晶体类型为.
-
(3) 碳、硅同一主族,CF4沸点比SiF4低的原因是;碳能形成π键而硅难形成π键的主要原因是.
-
(4) 图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构,该化合物的分子式为,若其晶体中分子的堆积方式与干冰相同,则晶体中每个分子的配位数是.

-
(5) 碳、硅两种元素形成的一种高硬度化合物的晶胞如图2所示,若该化合物的密度为ρg•cm3 , 晶胞参数为a pm,则阿伏加德罗常数为 mol﹣1 .
YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,关于  Y的说法正确的是( )
Y的说法正确的是( )
 Y的说法正确的是( )
Y的说法正确的是( )
A . 钇在周期表中的位置是第4周期ⅢB族
B . 属于非金属元素
C .  Y和
Y和  Y是两种不同的核素
D . 中子数为39
Y是两种不同的核素
D . 中子数为39
 Y和
Y和  Y是两种不同的核素
D . 中子数为39
Y是两种不同的核素
D . 中子数为39
某元素的一种核素X的质量数为A,含N个中子,它与2H原子组成2HmX分子.在a g 2HmX中所含质子的物质的量是( )
A . 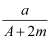 (A﹣N+m) mol
B .
(A﹣N+m) mol
B . 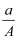 (A﹣N) mol
C .
(A﹣N) mol
C .  (A﹣N) mol
D .
(A﹣N) mol
D . 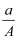 (A﹣N+2m) mol
(A﹣N+2m) mol
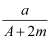 (A﹣N+m) mol
B .
(A﹣N+m) mol
B . 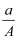 (A﹣N) mol
C .
(A﹣N) mol
C .  (A﹣N) mol
D .
(A﹣N) mol
D . 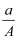 (A﹣N+2m) mol
(A﹣N+2m) mol
ABn型分子中,若A原子的最外层未达到稳定结构,则该分子被称为缺电子分子.下列分子属于缺电子分子的是( )
A . CO2
B . MgCl2
C . BF3
D . PCl3
某元素的一种同位素X的原子质量数为A,含N个中子,它与 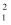 H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
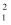 H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
A . 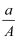 (A﹣N+2m)mol
B .
(A﹣N+2m)mol
B . 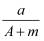 (A﹣N)mol
C .
(A﹣N)mol
C . 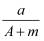 (A﹣N+2m)mol
D .
(A﹣N+2m)mol
D .  (A﹣N+m)mol
(A﹣N+m)mol
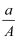 (A﹣N+2m)mol
B .
(A﹣N+2m)mol
B . 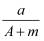 (A﹣N)mol
C .
(A﹣N)mol
C . 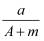 (A﹣N+2m)mol
D .
(A﹣N+2m)mol
D .  (A﹣N+m)mol
(A﹣N+m)mol
下列各原子或离子的电子排布式错误的是( )
A . Mg2+ 1s22s22p6
B . F 1s22s22p5
C . Ar 1s22s22p63s23p6
D . Cr 1s22s22p63s23p63d44s2
[化学一选修3:物质结构与性质]我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
-
(1) Cu2+的未成对电子数有个,H、O、S 电负性由大到小的顺序为。
-
(2) 在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。
①[Cu(NH3)4]SO4中化学键类型有,[Cu(NH3)4]2+ 的结构简式为,阴离子中心原子杂化类型为。
②氨的沸点远高于膦(PH3),原因是。
-
(3) 铁铜合金晶体类型为;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因。
-
(4) 金铜合金的一种晶体结构为立方晶型,如图所示。
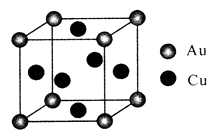
①该合金的化学式为;
②已知该合金的密度为dg/cm3 , 阿伏加德罗常数值为NA , 两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为cm(写出计算表达式)。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

-
(1) 写出24号元素Cr的基态原子的电子排布式。
-
(2) 元素e的基态原子的电子排布图:。
-
(3) c有种运动不同的电子
-
(4) 比较g、h、i三种元素的第一电离能的大小顺序:(按由大到小的顺序排列,用元素符号表示)。
-
(5) 图中o、p两元素的部分电离能数据列于下表:
元素
o
p
电离能/(kJ·mol-1)
I1
717
759
I2
1 509
1 561
I3
3 248
2 957
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是。
-
(6) 第3周期主族元素按单质熔点高低的顺序如图所示,横坐标序号“8”代表(填元素符号,下同)其中电负性最大的是。

A、X、Y、B、C、D、E、M是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;X的基态原子次外层有2个电子,最外层有3个未成对电子;Y原子的2p轨道上有1个电子的自旋方向与其它电子相反;B的价层电子排布式为ns1 , C和Y形成的化合物是引起酸雨的主要大气污染物,常温下,D的单质是一种黄绿色的气体;E的+3价离子的3d轨道为半充满状态,M与E元素位于同一周期,且为ⅠB族元素。
-
(1) B、Y、C分别形成的简单离子的半径由大到小顺序为(填离子符号)
-
(2) 元素D基态原子的核外电子排布式为,其同周期元素中,第一电离能最大的是(写元素符号)。
-
(3) M与D形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为

②此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为,其中配位体为分子(填“极性”或“非极性”),
-
(4) 基态C原子电子占据最高能级的电子云轮廓图为形。将A2C通入ED3溶液中反应的离子方程式为
-
(5) 用200mL1mol·L-1的BYA溶液吸收4.48L(标准状况)CY2所得溶液的pH<7,溶液中离子浓度由大到小的顺序为。
-
(6) 工业上用电化学法治理酸性废液中XY3−的原理如图,阴极的电极反应式为。

固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子  如
如  提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图
提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图 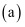 所示的锂超离子导体
所示的锂超离子导体  和图
和图  所示的有“点缺陷”的NaCl。
所示的有“点缺陷”的NaCl。
 如
如 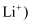 提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图
提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图  所示的锂超离子导体
所示的锂超离子导体  和图
和图  所示的有“点缺陷”的NaCl。
所示的有“点缺陷”的NaCl。 
根据所学知识回答下列问题:
-
(1) 在变化“Cl+e-→Cl-”过程中,所得电子填充在基态Cl的能级,此过程会
 填“吸收”或“释放”
填“吸收”或“释放”  能量。
能量。
-
(2)
 中B的杂化形式为,其等电子体为:
中B的杂化形式为,其等电子体为:  任写一种
任写一种  。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是。
。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是。
-
(3) 图
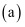 所示晶胞中
所示晶胞中  位于位置;若将晶体中形成宽敞通道的
位于位置;若将晶体中形成宽敞通道的  换成
换成  ,导电能力会明显降低,原因是。
,导电能力会明显降低,原因是。
-
(4) 图
 中,若缺陷处填充了
中,若缺陷处填充了  ,则它
,则它  填“是”或“不是”
填“是”或“不是” 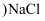 的晶胞,在NaCl晶体中,
的晶胞,在NaCl晶体中,  填充在
填充在  堆积而成的面体空隙中。
堆积而成的面体空隙中。
关于  的描述,下列正确的是( )
的描述,下列正确的是( )
 的描述,下列正确的是( )
的描述,下列正确的是( )
A . 该微粒核外有Z个电子
B . 该微粒核外有A个电子
C . 该微粒核外有Z+n个电子
D . 该微粒核外有Z-n个电子
某元素的原子核外有三个电子层,其 3p 能级上的电子数是 3s 能级上的一半,则此元素是( )
A . S
B . Al
C . Si
D . Cl
下列说法正确的是( )
A . 12CO与14CO互为同位素
B . 石墨、金刚石、C60互为同素异形体
C . C2H6O与C3H8O一定是同系物
D . CH3COOCH2CH3与CH3CH2OOCH3互为同分异构体
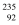 U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。 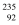 U的浓缩一直为国际社会所关注。下列有关
U的浓缩一直为国际社会所关注。下列有关 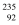 U的说法中正确的是( )
U的说法中正确的是( )
A . 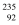 U原子核中含有92个中子
B .
U原子核中含有92个中子
B . 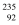 U原子核外有143个电子
C .
U原子核外有143个电子
C . 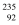 U与
U与  U互为同位素
D .
U互为同位素
D . 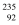 U与
U与  U互为同素异形体
U互为同素异形体
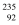 U原子核中含有92个中子
B .
U原子核中含有92个中子
B . 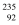 U原子核外有143个电子
C .
U原子核外有143个电子
C . 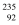 U与
U与  U互为同位素
D .
U互为同位素
D . 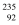 U与
U与  U互为同素异形体
U互为同素异形体
下列化学用语正确的是( )
A . 中子数为18的氯原子: Cl
B . CO2分子的电子式:
Cl
B . CO2分子的电子式: C . 顺-2-丁烯的结构简式:
C . 顺-2-丁烯的结构简式: D . 铝离子的结构示意图:
D . 铝离子的结构示意图:
 Cl
B . CO2分子的电子式:
Cl
B . CO2分子的电子式: C . 顺-2-丁烯的结构简式:
C . 顺-2-丁烯的结构简式: D . 铝离子的结构示意图:
D . 铝离子的结构示意图:
最近更新



