1.3 жҸӯејҖеҺҹеӯҗж ёеӨ–з”өеӯҗиҝҗеҠЁзҡ„йқўзәұ зҹҘиҜҶзӮ№йўҳеә“
-
пјҲ1пјү еӣҫ1жҳҜжҹҗеҗҢеӯҰз”»еҮәCOеҲҶеӯҗдёӯж°§еҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғеӣҫпјҢ

иҜ·еҲӨж–ӯиҜҘжҺ’еёғеӣҫпјҲеЎ«вҖңжӯЈзЎ®вҖқжҲ–вҖңй”ҷиҜҜвҖқпјүпјҢзҗҶз”ұжҳҜпјҲиӢҘеҲӨж–ӯжӯЈзЎ®пјҢиҜҘз©әдёҚз”Ёеӣһзӯ”пјүпјҺ
-
пјҲ2пјү еҶҷеҮәдёӨз§ҚдёҺCOдә’дёәзӯүз”өеӯҗдҪ“зҡ„зҰ»еӯҗпјҺ
-
пјҲ3пјү еҗ‘CuSO4жә¶ж¶ІдёӯеҠ е…Ҙи¶ійҮҸж°Ёж°ҙеҸҜеҫ—еҲ°ж·ұи“қиүІ[CuпјҲNH3пјү4]SO4жә¶ж¶ІпјҢ[CuпјҲNH3пјү4]SO4дёӯ жүҖеҗ«й…ҚдҪҚй”®жҳҜйҖҡиҝҮй…ҚдҪ“еҲҶеӯҗзҡ„з»ҷеҮәеӯӨз”өеӯҗеҜ№пјҢжҺҘеҸ—з”өеӯҗеҜ№еҪўжҲҗпјҢSO42п№Јзҡ„з©әй—ҙжһ„еһӢжҳҜпјҢиҜҘзү©иҙЁдёӯNгҖҒOгҖҒSдёүз§Қе…ғзҙ зҡ„第дёҖз”өзҰ»иғҪеӨ§е°ҸйЎәеәҸдёәпјһпјһпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјҺ
-
пјҲ4пјү з”ІйҶҮдёҺд№ҷзғ·зҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸзӣёиҝ‘пјҢж•…дәҢиҖ…еҲҶеӯҗй—ҙзҡ„дҪңз”ЁеҠӣпјҲиҢғеҫ·еҚҺеҠӣпјүзӣёиҝ‘пјҢдҪҶжҳҜдәҢиҖ…жІёзӮ№зҡ„е·®и·қеҚҙеҫҲеӨ§пјҢйҖ жҲҗиҜҘе·®ејӮзҡ„еҺҹеӣ жҳҜпјӣеңЁз”ІйҶҮеҲҶеӯҗдёӯзўіеҺҹеӯҗиҪЁйҒ“зҡ„жқӮеҢ–зұ»еһӢдёәпјҺ
-
пјҲ5пјү з”ІйҶӣдёҺж–°еҲ¶CuпјҲOHпјү2жӮ¬жөҠж¶ІеҠ зғӯеҸҜеҫ—з –зәўиүІжІүж·ҖCu2OпјҢе·ІзҹҘCu2Oжҷ¶иғһзҡ„з»“жһ„еҰӮеӣҫ2жүҖзӨәпјҡ
в‘ еңЁиҜҘжҷ¶иғһдёӯпјҢCu+зҡ„й…ҚдҪҚж•°жҳҜпјҢ
в‘ЎиӢҘиҜҘжҷ¶иғһзҡ„иҫ№й•ҝдёәa pmпјҢеҲҷCu2Oзҡ„еҜҶеәҰдёә gвҖўcmп№Ј3пјҲеҸӘиҰҒжұӮеҲ—з®—ејҸпјҢдёҚеҝ…и®Ўз®—еҮәж•°еҖјпјҢйҳҝдјҸеҠ еҫ·зҪ—еёёж•°дёәNAпјү
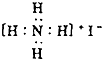 D . H2OпјҢCO2зҡ„жҜ”дҫӢжЁЎеһӢйғҪеҸҜд»Ҙз”Ё
D . H2OпјҢCO2зҡ„жҜ”дҫӢжЁЎеһӢйғҪеҸҜд»Ҙз”Ё  Cl
B . ж°ҜзҰ»еӯҗпјҲClп№Јпјүзҡ„з»“жһ„зӨәж„Ҹеӣҫ
Cl
B . ж°ҜзҰ»еӯҗпјҲClп№Јпјүзҡ„з»“жһ„зӨәж„Ҹеӣҫ  C . ж°Ҝж°”зҡ„з”өеӯҗејҸ
C . ж°Ҝж°”зҡ„з”өеӯҗејҸ  D . ж°Ёзҡ„еҲҶеӯҗејҸ NH3
D . ж°Ёзҡ„еҲҶеӯҗејҸ NH3
дёӢйқўжҳҜдёҖдәӣжҷ¶дҪ“жқҗж–ҷзҡ„з»“жһ„зӨәж„ҸеӣҫпјҺ
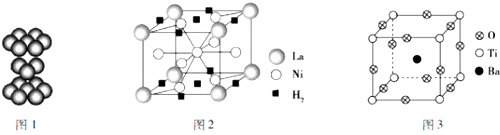
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү еҶҷеҮәй•ҚеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸпјҡпјҺ
-
пјҲ2пјү й’ӣйҮ‘еұһжҷ¶дҪ“зҡ„еҺҹеӯҗе Ҷз§Ҝж–№ејҸеҰӮеӣҫ1жүҖзӨәпјҢеҲҷжҜҸдёӘй’ӣеҺҹеӯҗе‘ЁеӣҙжңүдёӘзҙ§йӮ»зҡ„й’ӣеҺҹеӯҗпјҺ
-
пјҲ3пјү 镧系еҗҲйҮ‘жҳҜзЁҖеңҹзі»еӮЁж°ўеҗҲйҮ‘зҡ„е…ёеһӢд»ЈиЎЁпјҺжҹҗеҗҲйҮ‘еӮЁж°ўеҗҺзҡ„жҷ¶иғһеҰӮеӣҫ2жүҖзӨәпјҢиҜҘеҗҲйҮ‘зҡ„еҢ–еӯҰејҸдёәпјҢ1mol镧еҪўжҲҗзҡ„иҜҘеҗҲйҮ‘иғҪеӮЁеӯҳ molж°ўж°”пјҺ
-
пјҲ4пјү е«ҰеЁҘдёүеҸ·еҚ«жҳҹдёҠзҡ„PTCе…ғ件пјҲзғӯж•Ҹз”өйҳ»пјүзҡ„дё»иҰҒжҲҗеҲҶп№Јп№Јй’Ўй’ӣзҹҝжҷ¶дҪ“з»“жһ„еҰӮеӣҫ3жүҖзӨәпјҢиҜҘжҷ¶дҪ“з»ҸXе°„зәҝеҲҶжһҗйүҙе®ҡпјҢйҮҚеӨҚеҚ•дҪҚдёәз«Ӣж–№дҪ“пјҢиҫ№й•ҝдёәacmпјҺйЎ¶зӮ№дҪҚзҪ®иў«Ti4+жүҖеҚ жҚ®пјҢдҪ“еҝғдҪҚзҪ®иў«Ba2+жүҖеҚ жҚ®пјҢжүҖжңүжЈұеҝғдҪҚзҪ®иў«O2п№ЈжүҖеҚ жҚ®пјҺ
в‘ иҜҘжҷ¶дҪ“дёӯзҡ„Oе…ғзҙ дёҺж°ўеҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„дёӯеҝғеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢдёәпјҢе…¶еҲҶеӯҗз©әй—ҙжһ„еһӢдёәпјҺ
в‘ЎиҜҘжҷ¶дҪ“дёӯзҡ„Oе…ғзҙ дёҺе…¶еҗҢе‘Ёжңҹе·ҰеҸізӣёйӮ»зҡ„е…ғзҙ 第дёҖз”өзҰ»иғҪз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜпјҢз”өиҙҹжҖ§з”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸжҳҜпјҺ
в‘ўеҶҷеҮәиҜҘжҷ¶дҪ“зҡ„еҢ–еӯҰејҸпјҡпјҺ
в‘ЈиӢҘиҜҘжҷ¶дҪ“зҡ„еҜҶеәҰдёәПҒg/cm3 пјҢ йҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёәNA пјҢ еҲҷa=cmпјҺ
 B .
B .  C .
C .  D .
D . 
-
пјҲ1пјү 84ж¶ҲжҜ’ж¶Ізҡ„дё»иҰҒжҲҗеҲҶжҳҜж¬Ўж°Ҝй…ёй’ пјҢеҶҷеҮәж¬Ўж°Ҝй…ёй’ зҡ„з”өеӯҗејҸпјҡгҖӮ
-
пјҲ2пјү жҙҒеҺ•зҒөзҡ„дё»иҰҒжҲҗеҲҶжҳҜHClгҖӮдёӢеҲ—е…ідәҺеҚӨеҢ–ж°ўзҡ„жҖ§иҙЁжҜ”иҫғдёӯй”ҷиҜҜзҡ„жҳҜA . й…ёжҖ§пјҡHF>HCl>HBr>HI B . й”®иғҪпјҡHвҖ”F>HвҖ”Cl>HвҖ”Br>HвҖ”I C . зҶ”зӮ№пјҡHF<HCl<HBr<HI D . иҝҳеҺҹжҖ§пјҡHF<HCl<HBr<HI
-
пјҲ3пјү еёёжё©дёӢпјҢ0.1mol/Lзҡ„NaClOжә¶ж¶Ізҡ„pH=9.7пјҢеҺҹеӣ гҖӮеёёжё©дёӢHClOзҡ„з”өзҰ»е№іиЎЎеёёж•°дёәгҖӮжҙҒеҺ•ж¶ІдёҺ84ж¶ҲжҜ’ж¶Іж··еҗҲеҗҺдјҡз”ҹжҲҗжңүжҜ’зҡ„ж°Ҝж°”гҖӮеҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ4пјү й«ҳй“Ғй…ёй’ҫжҳҜдёҖз§Қй«ҳж•ҲеӨҡеҠҹиғҪж°ҙеӨ„зҗҶеүӮпјҢе·ҘдёҡдёҠеёёйҮҮз”ЁNaClOж°§еҢ–жі•з”ҹдә§пјҢеҸҚеә”еҺҹзҗҶдёәпјҡ
в‘ еңЁзўұжҖ§жқЎд»¶дёӢпјҢеҲ©з”ЁNaClOж°§еҢ–зЎқй…ёй“ҒпјҢеҲ¶еҫ—Na2FeO4 пјҢ иҜҘеҸҚеә”зҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸдёәгҖӮ
в‘ЎNa2FeO4дёҺKOHеҸҚеә”з”ҹжҲҗK2FeO4пјҡNa2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4еңЁж°ҙжә¶ж¶Ідёӯжҳ“ж°ҙи§Јпјҡ4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2 пјҢ еңЁвҖңжҸҗзәҜвҖқK2FeO4дёӯйҮҮз”ЁйҮҚз»“жҷ¶гҖҒжҙ—ж¶ӨгҖҒдҪҺжё©зғҳе№Ізҡ„ж–№жі•пјҢеҲҷжҙ—ж¶ӨеүӮжңҖеҘҪйҖүз”Ёжә¶ж¶І(еЎ«еәҸеҸ·)
4Fe(OH)3+8OH-+3O2 пјҢ еңЁвҖңжҸҗзәҜвҖқK2FeO4дёӯйҮҮз”ЁйҮҚз»“жҷ¶гҖҒжҙ—ж¶ӨгҖҒдҪҺжё©зғҳе№Ізҡ„ж–№жі•пјҢеҲҷжҙ—ж¶ӨеүӮжңҖеҘҪйҖүз”Ёжә¶ж¶І(еЎ«еәҸеҸ·)AпјҺж°ҙ BпјҺNH4ClгҖҒејӮдёҷйҶҮ CпјҺFe(NO3)3гҖҒејӮдёҷйҶҮ DпјҺCH3COONaгҖҒејӮдёҷйҶҮ
-
пјҲ1пјү жҢүзі»з»ҹе‘ҪеҗҚжі•з»ҷдёӢеҲ—жңүжңәзү©е‘ҪеҗҚпјҡ
в‘ (CH3)2CHCH(Cl)CH3пјҡгҖӮ
в‘Ў
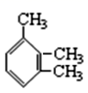 пјҡгҖӮ
пјҡгҖӮ -
пјҲ2пјү зҫҹеҹәзҡ„з”өеӯҗејҸжҳҜпјҡгҖӮ
-
пјҲ3пјү 2-з”Іеҹә-1-дёҒзғҜзҡ„й”®зәҝејҸпјҡгҖӮ
-
пјҲ4пјү зӣёеҜ№еҲҶеӯҗиҙЁйҮҸжңҖе°Ҹзҡ„жңүжңәзү©з©әй—ҙжһ„еһӢжҳҜгҖӮ
-
пјҲ5пјү 3-з”ІеҹәжҲҠзғ·зҡ„дёҖж°Ҝд»Јдә§зү©жңүз§Қ(иҖғиҷ‘з«ӢдҪ“ејӮжһ„)гҖӮ
-
пјҲ6пјү й«ҳеҲҶеӯҗеҢ–еҗҲзү©
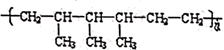 зҡ„еҚ•дҪ“еҲҶеҲ«жҳҜгҖӮ
зҡ„еҚ•дҪ“еҲҶеҲ«жҳҜгҖӮ
-
пјҲ7пјү еҶҷеҮәдёӢеҲ—жңүжңәеҸҚеә”зҡ„ж–№зЁӢејҸпјҡ
в‘ 2-жәҙдёҷзғ·зҡ„ж°ҙи§ЈеҸҚеә”пјҡгҖӮ
в‘Ў3-з”Іеҹә-2-дёҒйҶҮзҡ„еӮ¬еҢ–ж°§еҢ–еҸҚеә”пјҡгҖӮ
в‘ўе®һйӘҢе®ӨеҲ¶д№ҷзғҜпјҡгҖӮ
в‘ЈеҜ№иӢҜдәҢз”Ій…ёе’Ңд№ҷдәҢйҶҮзҡ„зј©иҒҡеҸҚеә”пјҡгҖӮ
 B . CaCl2зҡ„з”өеӯҗејҸдёәпјҡ
B . CaCl2зҡ„з”өеӯҗејҸдёәпјҡ 

иҜ·жҢүиҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү е…ғзҙ в‘Је…ғзҙ еҗҚз§°гҖӮ
-
пјҲ2пјү е…ғзҙ в‘Ўе’Ңв‘ЈеҪўжҲҗзҡ„еҢ–еҗҲзү©дёӯзҡ„еҢ–еӯҰй”®жҳҜй”®(еЎ«вҖңзҰ»еӯҗвҖқжҲ–вҖңе…ұд»·вҖқ)гҖӮ
-
пјҲ3пјү е…ғзҙ в‘ еҚ•иҙЁзҡ„з”өеӯҗејҸдёәгҖӮ
-
пјҲ4пјү е…ғзҙ в‘ЎпҪһв‘Өзҡ„еҺҹеӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёә(еЎ«е…ғзҙ з¬ҰеҸ·)пјҢе®ғ们зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯпјҢй…ёжҖ§жңҖејәзҡ„жҳҜ(еЎ«еҢ–еӯҰејҸ)гҖӮ
-
пјҲ5пјү е…ғзҙ в‘Ўе’Ңв‘Өзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ6пјү е…ғзҙ в‘Је’Ңв‘ӨеҪўжҲҗзҡ„ж°ўеҢ–зү©дёӯзЁіе®ҡжҖ§пјһ
-
пјҲ7пјү е…ғзҙ в‘ пҪһв‘ӨдёӯпјҢйҮ‘еұһжҖ§жңҖејәзҡ„жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·)пјҢйқһйҮ‘еұһжҖ§жңҖејәзҡ„жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·)гҖӮ
 пјүдёӯеӯҳеңЁе…ұд»·й”®
C . ж–°еһӢеҺҹз”өжұ жқҗж–ҷзЈ·й…ёзӣҗLi1п№ЈxFePO4дёӯFeжҳҫ+2д»·
D . зҰ»еӯҗз»“жһ„зӨәж„Ҹеӣҫдёә
пјүдёӯеӯҳеңЁе…ұд»·й”®
C . ж–°еһӢеҺҹз”өжұ жқҗж–ҷзЈ·й…ёзӣҗLi1п№ЈxFePO4дёӯFeжҳҫ+2д»·
D . зҰ»еӯҗз»“жһ„зӨәж„Ҹеӣҫдёә  зҡ„зІ’еӯҗиғҪиЎЁзӨә35Clп№ЈжҲ–37Clп№Ј
зҡ„зІ’еӯҗиғҪиЎЁзӨә35Clп№ЈжҲ–37Clп№Ј
 гҖҒCOгҖҒ
гҖҒCOгҖҒ  гҖҒCuгҖҒ
гҖҒCuгҖҒ  гҖҒ
гҖҒ  зӯүзү©иҙЁпјҢж №жҚ®е®ғ们зҡ„з»„жҲҗеҸҠжҖ§иҙЁиҝӣиЎҢеҰӮеӣҫеҲҶзұ»пјҡ
зӯүзү©иҙЁпјҢж №жҚ®е®ғ们зҡ„з»„жҲҗеҸҠжҖ§иҙЁиҝӣиЎҢеҰӮеӣҫеҲҶзұ»пјҡ  иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү ж·Ўй»„иүІеӣәдҪ“жңҖз»ҲдҪҚдәҺз»„пјҢе®ғзҡ„з”өеӯҗејҸдёәгҖӮиҜҘзү©иҙЁдёҺж°ҙеҸҚеә”пјҢиӢҘжңү
 дёӘз”өеӯҗиҪ¬з§»пјҢеҲҷжңүmolиҜҘзү©иҙЁеҸӮдёҺеҸҚеә”гҖӮ
дёӘз”өеӯҗиҪ¬з§»пјҢеҲҷжңүmolиҜҘзү©иҙЁеҸӮдёҺеҸҚеә”гҖӮ
-
пјҲ2пјү еҶҷеҮәе®һйӘҢе®ӨеҲ¶еӨҮв… з»„дёӯж°”дҪ“зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ3пјү Bз»„дёӯзҡ„зү©иҙЁиғҪдёҺзЁҖзЎқй…ёеҸҚеә”пјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ4пјү в…Ўз»„дёӯзҡ„зү©иҙЁж»ҙе…Ҙж°ҙдёӯеҗҺдёҺж°ҙеү§зғҲеҸҚеә”дә§з”ҹеӨ§йҮҸй…ёйӣҫпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
 зҡ„еҲҶеӯҗз»“жһ„жЁЎеһӢпјҡ
зҡ„еҲҶеӯҗз»“жһ„жЁЎеһӢпјҡ B . ж ёеҶ…жңү36дёӘдёӯеӯҗзҡ„й“ңеҺҹеӯҗпјҡ
B . ж ёеҶ…жңү36дёӘдёӯеӯҗзҡ„й“ңеҺҹеӯҗпјҡ C .
C .  зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ D .
D .  зҡ„з»“жһ„ејҸпјҡ
зҡ„з»“жһ„ејҸпјҡ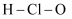
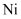 зҡ„д»·еұӮз”өеӯҗжҺ’еёғдёӯпјҢеӨ„дәҺеҹәжҖҒзҡ„жҳҜпјҲ пјү
зҡ„д»·еұӮз”өеӯҗжҺ’еёғдёӯпјҢеӨ„дәҺеҹәжҖҒзҡ„жҳҜпјҲ пјү
 B .
B .  C .
C .  D .
D . 

-
пјҲ1пјү еҹәжҖҒй“ңеҺҹеӯҗзҡ„д»·еұӮз”өеӯҗжҺ’еёғејҸдёәпјҢдҪҚдәҺе‘ЁжңҹиЎЁдёӯ第周жңҹж—ҸгҖӮ
-
пјҲ2пјү иғҶзҹҫдёӯSеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸжҳҜпјҢHгҖҒOгҖҒSдёӯпјҢ第дёҖз”өзҰ»иғҪжңҖеӨ§зҡ„е…ғзҙ жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·)
-
пјҲ3пјү иғҶзҹҫдёӯеӯҳеңЁзҡ„еҢ–еӯҰй”®жңүй…ҚдҪҚй”®гҖҒгҖӮ
-
пјҲ4пјү еҗ«зЎ«еҢ–еҗҲзү©SOCl2зҡ„VSEPRжЁЎеһӢжҳҜпјҢиҜ•еҲҶжһҗиҜҘеҲҶеӯҗдёӯеҒҘи§’вҲ Cl-S-OеӨ§дәҺвҲ Cl-S-Clзҡ„еҺҹеӣ жҳҜгҖӮ
-
пјҲ5пјү з«Ӣж–№й“ңжҷ¶иғһдёӯй“ңеҺҹеӯҗзҡ„й…ҚдҪҚж•°дёә12пјҢеҲҷжҜҸдёӘжҷ¶иғһдёӯжңүдёӘй“ңеҺҹеӯҗпјҢй“ңеҺҹеӯҗзҡ„еҚҠеҫ„дёәrcmпјҢеҲҷй“ңжҷ¶дҪ“зҡ„еҜҶеәҰдёәgВ·cm-3(йҳҝдјҸеҠ еҫ·зҪ—еёёж•°еҖјз”ЁNAиЎЁзӨә)гҖӮ

-
пјҲ1пјү еҶҷеҮәеҹәжҖҒMnеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғ гҖӮ
-
пјҲ2пјү TMCM-MnCl3жҷ¶иғһеҶ…еҗ«жңүдёӘMnеҺҹеӯҗгҖҒ дёӘClеҺҹеӯҗпјҢжңүжңәеҹәеӣўзҡ„з»“жһ„з®ҖејҸдёәгҖӮ
-
пјҲ3пјү TMCM-MnCl3жҷ¶дҪ“дёӯжңүжңәз»“жһ„еҚ•е…ғдёӯCеҺҹеӯҗжқӮеҢ–зұ»еһӢжҳҜпјҢNеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢжҳҜпјҢиҜҘжҷ¶дҪ“дёӯеӯҳеңЁ(еЎ«еҰӮдёӢйҖүйЎ№ж ҮеҸ·)гҖӮ
AпјҺиҢғеҫ·еҚҺеҠӣ BпјҺзҰ»еӯҗй”® CпјҺПҖй”® DпјҺПғй”®
-
пјҲ4пјү TMCM-MnCl3жҷ¶дҪ“дёӯпјҢCl-Cй—ҙзҡ„еҢ–еӯҰй”®дёәй”®пјҢCl-Mnй—ҙзҡ„еҢ–еӯҰй”®дёәй”®пјӣе…¶дёӯMnзҡ„еҢ–еҗҲд»·дёәгҖӮ



