1.3 揭开原子核外电子运动的面纱 知识点题库
例:只要功夫深,Fe 杵磨成针
(1)雪中送
(2)千里送鹅毛,礼情意重
(3)黄 万两
(4)大快人
(5)感慨万
(6)高歌进
(7)青山水
(8)人杰地
(9) 丽可爱
(10)功高 世
(11)高贵雅
(12)花红绿
(13)群之马
(14)泊明志
-
(1) N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 I1 I2 I3 I4 …
In/kJ.mol﹣1 578 1817 2745 11578 …
则该元素是(填写元素符号).
-
(2) 基态锗(Ge)原子的电子排布式是.Ge的最高价氯化物分子式是.该元素可能的性质或应用有.
A.是一种活泼的金属元素 B.其电负性大于硫 C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
-
(3)
关于化合物
 , 下列叙述正确的有 . A . 分子间可形成氢键 B . 分子中既有极性键又有非极性键 C . 分子中有7个σ键和1个π键 D . 该分子在水中的溶解度大于2﹣丁烯
, 下列叙述正确的有 . A . 分子间可形成氢键 B . 分子中既有极性键又有非极性键 C . 分子中有7个σ键和1个π键 D . 该分子在水中的溶解度大于2﹣丁烯 -
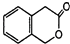
(4)
NaF的熔点
 的熔点(填>、=或<),其原因是.
的熔点(填>、=或<),其原因是.
-
(1)
 ;
;
-
(2)
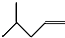 ;
;
-
(3)
 ;
;
-
(4)
 .
.
-
(1) NH4Cl;
-
(2) Na2O2;
-
(3) CO2;
-
(4) MgCl2;
-
(5) (1)~(4)中,仅含离子键的是,仅含共价键的是,既有离子键又有共价键的是.
-
(1) C元素的离子结构示意图,C元素形成的常见液态化合物的结构式。
-
(2) D元素在元素周期表中的位置,写出D在C单质中燃烧形成的化合物的电子式。
-
(3) B与C分别形成的简单气态氢化物中较稳定的是,其中B形成的简单气态氢化物的空间结构 ,画出B与C反应生成的XY2型化合物的电子式。
-
(4) 过量B的最高价氧化物与D的最高价氧化物对应的水化物的溶液反应的离子方程式。
-
(5) 分子式为B6A14的物质含有多种同分异构体,其中一种同分异构体的一氯代物只有两种,写出该种物质的结构简式。
-
(1) Ⅰ.羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染,研究其脱除方式意义重大。回答下列问题:
COS 的分子结构与 CO2 相似,COS 的电子式为。
-
(2) 已知:① CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1
H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1 ② COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1则氢气脱除 COS 生成 CO 和 H2S 的热化学方程式为。
-
(3) II. 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H 等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) = Si(s) + 4HCl(g) △H = + 236 kJ/mol
键能
Si—O
Si—Cl
H—H
H—Cl
Si—Si
Si—C
(kJ·mol-1)
460
360
436
431
x
347
表中 x=。
-
(4) Ⅲ. “绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3 = 7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图:

负极反应式为, 标准状况下有 4.48 L NO2 被处理时,转移电子的物质的量为mol。
-
(1) 乙烯的电子式,结构简式。
-
(2) 鉴别甲烷和乙烯的试剂是______(填序号)。A . 稀硫酸 B . 溴的四氯化碳溶液 C . 水 D . 酸性高锰酸钾溶液
-
(3) 下列物质中,可以通过乙烯加成反应得到的是______(填序号)。A . CH3CH3 B . CH3CHCl2 C . CH3CH2OH D . CH3CH2Br
-
(4) 已知 2CH3CHO+O2
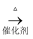 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。 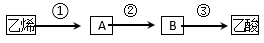
反应②的化学方程式为。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为。

已知:
G是具有果香气味的液体;D是重要的化工原料,并且可以代替汽油作汽车燃料。
-
(1) B的分子式为,该分子所含官能团的名称为。
-
(2) E的电子式为,G的结构简式为。
-
(3) D→E的化学方程式为。
-
(4) 写出足量的F与甘油在浓硫酸催化下反应生成酯的化学方程式,其反应类型为。
 B . 醛基(-CHO)的电子式:
B . 醛基(-CHO)的电子式: 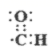 C . CH4的球棍模型:
C . CH4的球棍模型:  D . 乙烯分子的结构式:CH2=CH2
D . 乙烯分子的结构式:CH2=CH2
 B . 甲酸甲酯的最简式:
B . 甲酸甲酯的最简式:  C . 丙烷的球棍模型:
C . 丙烷的球棍模型: 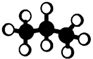 D . 氨基的电子式:
D . 氨基的电子式: 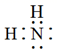

 常被称为绿色氧化剂。
常被称为绿色氧化剂。
-
(1)
 电子式是。
电子式是。
-
(2) 为分析
 对
对  分解反应的催化效果,某同学做了以下实验。
分解反应的催化效果,某同学做了以下实验。 实验ⅰ.向
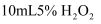 溶液中滴加5滴
溶液中滴加5滴  溶液,较快产生无色无味气体。
溶液,较快产生无色无味气体。实验ⅱ.向
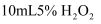 溶液中滴加5滴
溶液中滴加5滴  溶液,无气体产生。
溶液,无气体产生。由此推断
 对
对  分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b.
分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b. 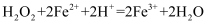 。实验ⅱ的目的是:。
。实验ⅱ的目的是:。 -
(3) 硏究表明:过氧化氢溶液中
 的浓度越大,过氧化氢的分解速率越快。
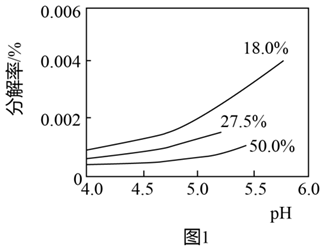
的浓度越大,过氧化氢的分解速率越快。 常温下,不同浓度的过氧化氢分解率与pH的关系如图1所示。
已知:
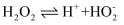 ,
, 
①一定条件下,相同时间内
 分解率随溶液
分解率随溶液  增大而增大的原因是:。
增大而增大的原因是:。②相同
 下,过氧化氢浓度越大分解速率越快,但是相同时间内
下,过氧化氢浓度越大分解速率越快,但是相同时间内  分解率反而降低,分析其原因。
分解率反而降低,分析其原因。 -
(4)
 常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。
常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。 ①酸性条件下
 腐蚀金属铜的离子方程式为。
腐蚀金属铜的离子方程式为。②图2是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因。
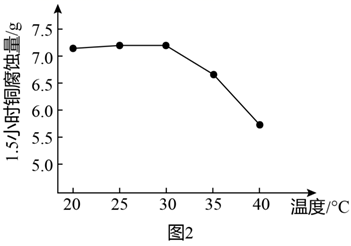
-
(1) 比较还原性强弱:I-Br-(填“>”“<”或“=”);用一个离子方程式说明I-与Br-的还原性相对强弱: 。
-
(2) CO2是共价化合物,各原子均满足8电子稳定结构。写出CO2的电子式。
-
(3) 请解释H2O的热稳定性高于H2S的原因。
 B . KNO3的电离方程式:KNO3=K++
B . KNO3的电离方程式:KNO3=K++ C . 用电子式表示NaCl的形成过程:
C . 用电子式表示NaCl的形成过程: D . H2还原CuO反应中电子的转移:
D . H2还原CuO反应中电子的转移:
 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解:  。回答下列问题:
。回答下列问题:
-
(1) 基态
 原子的电子排布式为,基态
原子的电子排布式为,基态  与
与  中未成对电子的数目之比为。
中未成对电子的数目之比为。
-
(2) 三草酸合铁酸钾所含元素中,第一电离能最大的是(填元素符号,下同),电负性最大的是。
-
(3) 1个
 与1个
与1个  分子中
分子中 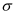 键数目之比为,
键数目之比为,  分子的立体构型为。
分子的立体构型为。
-
(4) 金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。
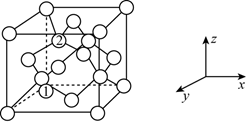
若图中原子1的坐标为
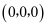 ,则原子2的坐标为。
,则原子2的坐标为。
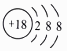
 C . 16O2 与18O2 互为同素异形体
D . 14C的原子结构示意图:
C . 16O2 与18O2 互为同素异形体
D . 14C的原子结构示意图:


