1.3 揭开原子核外电子运动的面纱 知识点题库
第四周期中的18种元素具有重要的用途.
-
(1) 已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为,中心原子的杂化类型为.
-
(2) 第四周期ⅤA﹣ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示).
-
(3) 金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子;配体NH3分子的空间构型为
-
(4) 金属钒在材料科学上有重要作用,被称为”合金的维生素”,基态钒原子的价电子排布式为,第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但Ga的第一电离能却明显低于Zn,原因是.
原子核外电子是分层排布的,在不同电子层上运动的电子的能量不同,下列电子层上运动的电子能量最高的是( )
A . K层
B . L层
C . M层
D . N层
下列关于化学用语的表示正确的是( )
A . 过氧化钠的电子式:  B . 质子数为35、中子数为45的溴原子:
B . 质子数为35、中子数为45的溴原子:  Br
C . 硫离子的结构示意图:
Br
C . 硫离子的结构示意图:  D . 乙烯的结构简式:CH2CH2
D . 乙烯的结构简式:CH2CH2
 Br
C . 硫离子的结构示意图:
Br
C . 硫离子的结构示意图:
列化学用语正确的是( )
A . 羟基的电子式:  B . 次氯酸的结构式:H﹣O﹣Cl
C . 中子数为20的氯原子:
B . 次氯酸的结构式:H﹣O﹣Cl
C . 中子数为20的氯原子: 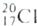 D . 乙烯的分子式:CH2═CH2
D . 乙烯的分子式:CH2═CH2
下列共价化合物中,分子中每个原子最外电子层都满足8电子结构的是( )
A . BF3
B . BeCl2
C . PCl3
D . SO3
下列关于乙炔的化学用语正确的是( )
A . 摩尔质量:26
B . 球棍模型:  C . 电子式:
C . 电子式:  D . 结构式:CH≡CH
D . 结构式:CH≡CH
下列表示式中错误的是( )
A . Na+的电子式:  B . Na+的结构示意图:
B . Na+的结构示意图:  C . Na的电子排布式:1s22s22p63s1
D . Na的简化电子排布式:3s1
C . Na的电子排布式:1s22s22p63s1
D . Na的简化电子排布式:3s1
已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下图转化关系,试推断回答下列问题。

-
(1) D元素原子的结构示意图为;
-
(2) A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
-
(3) Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
-
(4) A的气态氢化物的电子式 ;
-
(5) 实验室中,制取A的气态氢化物的化学方程式 。
下列表示物质结构的化学用语正确的是( )
A . 苯分子的比例模型:  B . HF的电子式:H:F
C . Cl-离子的结构示意图:
B . HF的电子式:H:F
C . Cl-离子的结构示意图:  D . NH4Cl的电子式:
D . NH4Cl的电子式: 
截止到2021年4月全球新冠肺炎确诊人数超过1亿,在阻击新冠肺炎的战役中最大程度的体现了我国的政治优势。防疫过程中,其中医用酒精和“84” 消毒液、双氧水等均能起到杀菌作用。下列有关说法错误的是( )
A . 酒精的分子式:C2H6O
B . NaClO的电子式:  C . HClO的结构式:H—Cl—O
D . H2O2的球棍模型:
C . HClO的结构式:H—Cl—O
D . H2O2的球棍模型: 
元素周期表中第四周期某些过渡元素(如Ti、Mn、Zn等)在生产生活中有着广泛的应用。回答下列问题:
-
(1) 钛的应用越来越受到人们的关注。
①第四周期元素中,基态原子的未成对电子数与钛相同的有(填元素符号)。
②钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是。
-
(2) 锰及其化合物的应用研究是前沿科学之一
①已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列(选填字母编号)。

②三醋酸锰[(CH3COO)3Mn]是一种很好的有机反应氧化剂。三醋酸锰[(CH3COO)3Mn]中阳离子的价层电子排布式中电子的自旋状态(填“相同”或“相反”)。
③Mn2+能形成配离子为八面体的配合物MnClm·nNH3 , 在该配合物的配离子中,Mn2+位于八面体的中心。若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1mol AgCl沉淀,则该配离子化学式为。
-
(3) 比较Fe和Mn的第三电离能,I3(Fe)I3(Mn)(填“大于”或“小于”),原因是。
-
(4) 某钙钛型复合氧化物如图,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有巨磁电阻效应。

已知La为+3价,当被钙等+2价元素A替代时,可形成复合钙钛矿化合物LaxA1-xMnO3 , (x>0.9),此时一部分+3价锰转变为+4价,导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则复合钙钛矿化合物中+3价锰与+4价锰的物质的量之比为(用含x的代数式表示)。
-
(5) 具有较高催化活性的材料金红石的晶胞结构如图所示。已知该晶体的密度为d g·cm-3 , Ti、O原子半径分别为a pm和b pm,阿伏加德罗常数的值为NA , 则金红石晶体的空间利用率为(列出计算式)。

按题目要求填空:
-
(1) 根据下列物质填空:①蔗糖 ②熔融
 ③氯气 ④NaOH固体。上述物质中不能导电,但属于电解质的是(填序号);③的电子式是。
③氯气 ④NaOH固体。上述物质中不能导电,但属于电解质的是(填序号);③的电子式是。
-
(2)
 是一种酸式盐,请填写下列空白:
是一种酸式盐,请填写下列空白: ①
 溶液与
溶液与  溶液反应的离子方程式为。
溶液反应的离子方程式为。②与0.1mol/L
 溶液中
溶液中  浓度相同的
浓度相同的  溶液的物质的量浓度为。
溶液的物质的量浓度为。 -
(3) 已知:
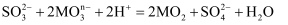 ,则
,则  中M的化合价是。
中M的化合价是。
-
(4) 已知钙的金属活泼性介于钾和钠之间,其化学性质与钠相似。钙与氧气在一定条件下可以反应生成过氧化钙(
 ),其性质与过氧化钠相似。回答下列问题:
),其性质与过氧化钠相似。回答下列问题: ①标出钙与水反应的电子转移方向和数目:。

②请写出
 与水反应的化学方程式;若向反应后的溶液中立即滴入酚酞,预期的实验现象可能是。
与水反应的化学方程式;若向反应后的溶液中立即滴入酚酞,预期的实验现象可能是。
下列表示不正确的是( )
A . 硫离子的结构示意图: B . 次氯酸的电子式:
B . 次氯酸的电子式: C .
C .  的分子结构模型:
的分子结构模型: D .
D .  的结构式:
的结构式: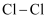
 B . 次氯酸的电子式:
B . 次氯酸的电子式: C .
C .  的分子结构模型:
的分子结构模型: D .
D .  的结构式:
的结构式: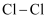
下表为九种主族元素在周期表中的位置:

请回答下列问题:
-
(1) 写出表中的元素符号A、C、I 、G
-
(2) I元素的位置是第周期,第族。
-
(3) H的原子结构示意图为。
-
(4) B的单质与G的单质反应的化学方程式为。
-
(5) B与F在点燃条件下生成的物质颜色为。
-
(6) E、F分别与A组成含10个电子的分子的化学式为、。
下列化学用语表述不正确的是( )
A . NaH的电子式为 B .
B .  表示的一定不是基态原子
C . 乙炔的结构简式为CHCH
D . 基态C原子价电子排布图为
表示的一定不是基态原子
C . 乙炔的结构简式为CHCH
D . 基态C原子价电子排布图为
 B .
B .  表示的一定不是基态原子
C . 乙炔的结构简式为CHCH
D . 基态C原子价电子排布图为
表示的一定不是基态原子
C . 乙炔的结构简式为CHCH
D . 基态C原子价电子排布图为
下列表示不正确的是( )
A . 硅原子的结构示意图: B . 丙烷的球棍模型:
B . 丙烷的球棍模型: C . 乙醇的的分子式:C2H6O
D . CO2分子的电子式:
C . 乙醇的的分子式:C2H6O
D . CO2分子的电子式:
 B . 丙烷的球棍模型:
B . 丙烷的球棍模型: C . 乙醇的的分子式:C2H6O
D . CO2分子的电子式:
C . 乙醇的的分子式:C2H6O
D . CO2分子的电子式:
在元素周期表中的某些元素之间存在着特殊的“对角线规则”,如Li和Mg、Be和Al、B和Si的一些性质相似。下列说法错误的是( )
A . 氢氧化铍是两性氢氧化物
B . B和Si的电负性数值相近
C . Li在N2中燃烧生成Li3N
D . Li和Mg的原子半径相近,且核外电子排布相同
配合物广泛应用于日常生活、工业生产及生命科学中。铜(+1)氰配离子 曾用作镀铜的电镀液,但因氰化物有毒,现已被无毒的焦磷酸合铜(+2)配离子
曾用作镀铜的电镀液,但因氰化物有毒,现已被无毒的焦磷酸合铜(+2)配离子 做电镀液来取代。
做电镀液来取代。
 曾用作镀铜的电镀液,但因氰化物有毒,现已被无毒的焦磷酸合铜(+2)配离子
曾用作镀铜的电镀液,但因氰化物有毒,现已被无毒的焦磷酸合铜(+2)配离子 做电镀液来取代。
做电镀液来取代。
-
(1) 写出基态
 的核外电子排布式:;与铜位于同一周期,且基态原子最高能层的电子数与基态Cu原子最高能层电子数相同的元素还有(填元素符号)。
的核外电子排布式:;与铜位于同一周期,且基态原子最高能层的电子数与基态Cu原子最高能层电子数相同的元素还有(填元素符号)。
-
(2) 配离子
 中,
中, 的配位数是;1 mol
的配位数是;1 mol  中含有
中含有 键的数目为。
键的数目为。
-
(3) 磷酸的结构可以表示为
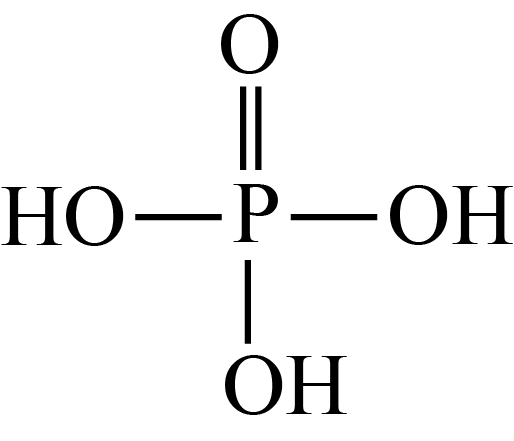 , 磷酸强热下可发生分子间脱水生成焦磷酸,则焦磷酸的分子式为;
, 磷酸强热下可发生分子间脱水生成焦磷酸,则焦磷酸的分子式为;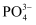 的空间构型是,与
的空间构型是,与 互为等电子体的离子有、(写出两种)
互为等电子体的离子有、(写出两种)
-
(4) 甘氨酸铜是一种常用的饲料添加剂,其分子结构如图,甘氨酸铜中所含的非金属元素,电负性由大到小排列的顺序是,碳原子的杂化方式为。
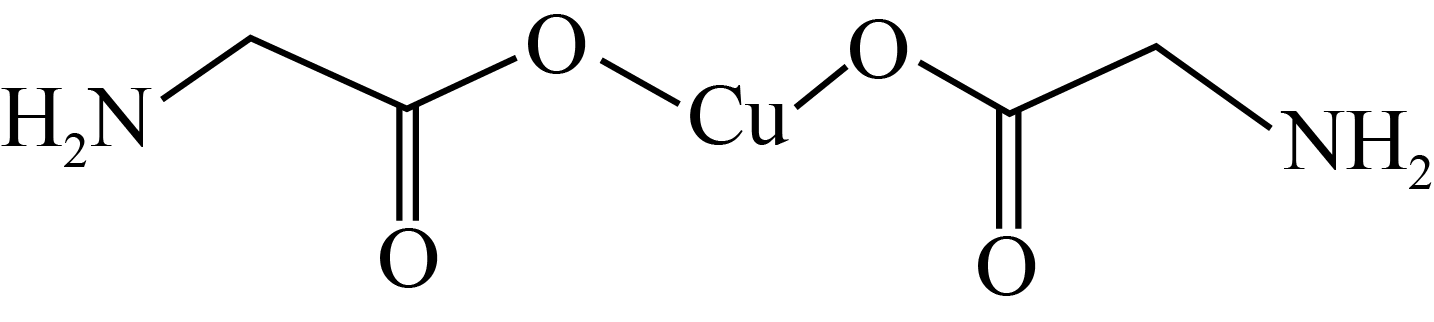
下列化学用语使用正确的是( )
A . 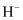 的离子结构示意图为:
的离子结构示意图为: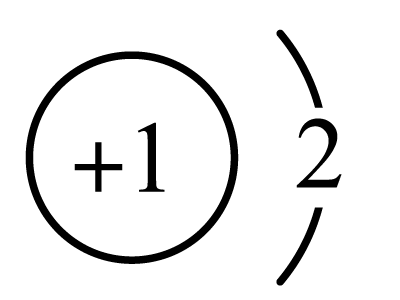 B . 二氧化碳的空间填充模型:
B . 二氧化碳的空间填充模型: C . 乙烯分子中的σ键:
C . 乙烯分子中的σ键: D .
D .  的电子式:
的电子式:
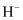 的离子结构示意图为:
的离子结构示意图为: D .
D .  的电子式:
的电子式:
化合物M是一种白色粉末,由四种原子序数小于30的元素组成。为探究M的组成,某高中探究性学习小组进行如下实验:

已知:①白色固体B可溶于无色气体C的水溶液中得到无色溶液
②流程中部分生成物已略去,气体产物完全逸出,沉淀均洗涤干净。请回答:
-
(1) 组成M的非金属元素有,C分子的电子式为。
-
(2) 写出M与盐酸反应的化学方程式。
-
(3) 请写出白色固体B溶于无色气体C的水溶液中得到无色溶液的离子方程式。
-
(4) 无色气体C可用于处理硝酸工厂的尾气,把尾气中的氮氧化物(
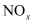 )转化为对空气无污染的物质,请写出该反应的化学方程式。
)转化为对空气无污染的物质,请写出该反应的化学方程式。
-
(5) 试设计实验检验沉淀D中的阳离子:。
最近更新



