1.3 揭开原子核外电子运动的面纱 知识点题库
下列化学用语表示正确的是( )
A . 氯化氢的电子式: 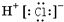 B . 甲烷的比例模型:
B . 甲烷的比例模型: 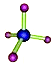 C . 水分子的结构式:H﹣O﹣H
D . 氯原子的结构示意图:
C . 水分子的结构式:H﹣O﹣H
D . 氯原子的结构示意图: 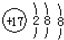
 C . 水分子的结构式:H﹣O﹣H
D . 氯原子的结构示意图:
C . 水分子的结构式:H﹣O﹣H
D . 氯原子的结构示意图:
化学科学需要借助化学专用语言来描述,下列化学用语使用正确的是( )
A . 二氧化碳分子的结构式为 O﹣C﹣O
B . 氟化钠的电子式: 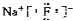 C . F原子的结构示意图:
C . F原子的结构示意图: 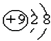 D . 用电子式表示氯化氢分子的形成过程:
D . 用电子式表示氯化氢分子的形成过程: 
下列化学用语正确的是( )
A . 硫化氢分子的电子式: 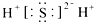 B . S2﹣的结构示意图:
B . S2﹣的结构示意图: 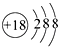 C . HClO的结构式:H﹣O﹣Cl
D . NH4Cl的电子式:
C . HClO的结构式:H﹣O﹣Cl
D . NH4Cl的电子式: 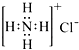
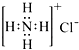
下列微粒中:①13Al3+② 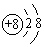 ③
③ 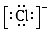 ④F﹣ , 其核外电子数相同的是( )
④F﹣ , 其核外电子数相同的是( )
A . ①②③
B . ②③④
C . ①②④
D . ①③④
下列化学用语表述正确的是( )
A . 水分子的结构式: 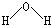 B . 氯化钠的电子式:
B . 氯化钠的电子式: 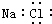 C . 苯的结构简式C6H6
D . 硫原子的结构示意图:
C . 苯的结构简式C6H6
D . 硫原子的结构示意图: 
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
-
(1) 基态铜原子的电子排布式为;已知高温下CuO→Cu2O+O2 , 从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是.
-
(2) 硒、硅均能与氢元素形成气态氢化物,若“Si﹣H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为SeSi(填“>”、“<”).与Si同周期部分元素的电离能如图1所示,其中a、b和c分别代表.
A.a为Il、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为Il、b为I3、c为I2
-
(3) SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为.
-
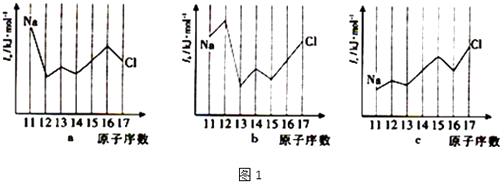
(4) 镓与某有机物形成的配合物过程如图2,在图上画出产物中的配位键.
-
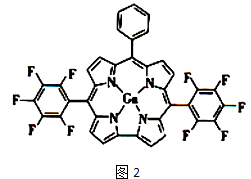
(5) 金刚砂(SiC)的硬度为9.5,其晶胞结构如图3所示,则Si原子的配位数为,每个C原子周围最近的C原子数目为个;若晶胞的边长为a pm,则金刚砂的密度表达式为 g/cm3 .
下列有关化学用语正确的是( )
A . N2的电子式:N⋮⋮N
B . 质子数为53,中子数为78的碘原子: 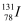 C . S2﹣的结构示意图:
C . S2﹣的结构示意图:  D . 硫酸铁的电离方程式:Fe2(SO4)3=Fe3++SO42﹣
D . 硫酸铁的电离方程式:Fe2(SO4)3=Fe3++SO42﹣
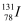 C . S2﹣的结构示意图:
C . S2﹣的结构示意图:
下列表示物质结构的化学用语正确的是( )
A . Cl﹣离子的结构示意图: 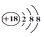 B . HF的电子式:
B . HF的电子式: 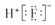 C . 8个中子的碳原子的核素符号:12C
D . CO2的结构式:O=C=O
C . 8个中子的碳原子的核素符号:12C
D . CO2的结构式:O=C=O
下列有关化学用语使用正确的是( )
A . 钙离子的结构示意图: 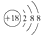 B . CH4分子的球棍模型:
B . CH4分子的球棍模型: 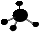 C . 乙烯的结构简式:CH2CH2
D . 丙烯的电子式:
C . 乙烯的结构简式:CH2CH2
D . 丙烯的电子式: 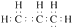
【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
-
(1) 元素As与N同族。预测As的氢化物分子的立体结构为,其沸点比NH3的(填“高”或“低”),其判断理由是。
-
(2) Fe成为阳离子时首先失去轨道电子,Sm的价层电子排布式为4f66s2 , Sm3+的价层电子排布式为。
-
(3) 比较离子半径:F−O2−(填“大于”等于”或“小于”)。
-
(4) 一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
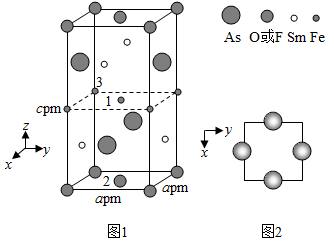
图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
 ,
,  ,
,  ),则原子2和3的坐标分别为、。
),则原子2和3的坐标分别为、。
锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
-
(1) Fe2+基态核外电子排布式为 。
-
(2) PO43-的空间构型为 (用文字描述)。
-
(3)
 中
中  的配位数为6,该配合物中的配位原子为 。
的配位数为6,该配合物中的配位原子为 。
-
(4) 碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为,1mol碳酸二乙酯(DEC)中含有σ键的数目为。
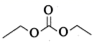
-
(5) 氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为。
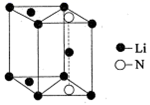
下表为元素周期表的一部分,分请回答有关问题:
|
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
① |
② |
||||||
|
3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
|
4 |
⑨ |
⑩ |
-
(1) ③与⑦形成的化合物的电子式为。
-
(2) 表中最活泼的金属是,非金属性最强的元素是。(填元素符号,下同)
-
(3) 表中能形成两性氢氧化物的元素是,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物对应的水化物反应的离子方程式,。
-
(4) 请设计—个实验,比较⑦和⑩的单质氧化性的。
四种短周期元素X、Y、Z、R的原子序数依次增大,X和Z位于同主族且能组成离子化合物;Y的质子数与其阴离子的最外层电子数相等,R离子与Y的阴离子具有相同的电子排布。下列说法错误的是( )
A . 离子半径:Y>Z>R
B . X与Y形成的化合物可能具有强氧化性
C . R的单质及氧化物一定能被强碱溶液溶解
D . Y与Z形成的二元化合物中阴阳离子个数比为1:2
钴及其化合物在催化剂、磁性材料、电池等领域应用十分广泛。回答下列问题:
-
(1) 纳米氧化钴可以在室温下将甲醛完全催化氧化为CO2和H2O。
①基态钴原子的核外电子排布式为[Ar]。
②甲醛分子中三种元素电负性由大到小的顺序为(填元素符号);甲醛分子的立体构型为;分子中σ键与π键数目比为。
-
(2) [Co(NH3)6]Cl3是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是,NH3分子中氮原子的杂化轨道类型为,NH3是(填“极性”或“非极性”)分子。
-
(3) LiCoO2可用作锂离子电池的电极材料。在元素周期表中,与Li的化学性质最相似的邻族元素是(填元素符号),该元素基态原子核外M层电子的自旋状态(填“相同”或“相反”);LiF的熔点为848℃,属于晶体,LiF的熔点高于LiCl熔点(605℃)的原因是。
-
(4) 某钻化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图所示,已知晶胞参数为a nm,则此晶体的密度为(列出计算式即可)g·cm-3。
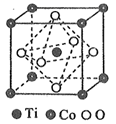
(CdSe)n小团簇(CdnSen,n=1~16)为Ⅱ-Ⅵ族化合物半导体材料,具有独特的光学和电学性质,常应用于发光二极管、生物系统成像与诊断等方面。
回答下列问题:
-
(1) 基态Se原子的价层电子排布式为。
-
(2) Cd的第一电离能大于同周期相邻元素,原因是。
-
(3) CdS、CdSe、CdTe均为重要的Ⅱ-Ⅵ族化合物半导体材料,熔点分别为1750℃、1350℃、1041℃,上述熔点呈规律性变化的原因是。
-
(4) 利用有机配体PH3、N(CH3)3等修饰(CdSe)2可改善其光致发光效率。其中PH3的空间构型是。N(CH3)3中参与形成配位键的孤电子对占据的轨道是。
-
(5) CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为(
 ,
, 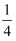 ,
, 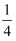 ),则B、C的原子坐标参数分别为。该晶胞中CdSe键的键长为。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为。
),则B、C的原子坐标参数分别为。该晶胞中CdSe键的键长为。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为。 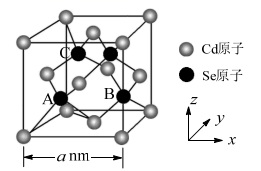
钛酸钙是最典型的钙钛矿型化合物,该类化合物具有特殊的理化性质。
-
(1) 基态
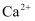 的核外电子排布式为。
的核外电子排布式为。
-
(2) 钛酸钙的晶胞如图所示,1个晶胞中含有
 的个数是。离子半径
的个数是。离子半径 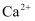 大于
大于  ,理由是。
,理由是。 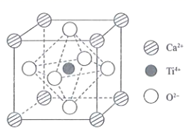
-
(3) 钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①晶体密度
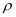 可以用晶胞的质量除以体积来求算。已知,钛酸钙晶胞的棱长为a pm(
可以用晶胞的质量除以体积来求算。已知,钛酸钙晶胞的棱长为a pm( 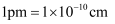 ),则钛酸钙晶体密度
),则钛酸钙晶体密度 
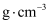 (列出计算式)
(列出计算式)②若忽略离子替代时的体积变化,下列钙钛矿型化合物中,密度大于钛酸钙的是(填字母序号)
a.
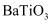 b.
b. 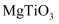 c.
c. 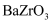
-
(4) 通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物
 。其中有机阳离子
。其中有机阳离子  可由甲胺(
可由甲胺(  )制得。
)制得。 ①
 中N的杂化方式为。
中N的杂化方式为。②请从化学键的角度解释由甲胺形成
 的过程:。
的过程:。
已知反应: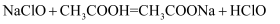 。下列相关化学用语表示正确的是( )
。下列相关化学用语表示正确的是( )
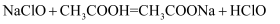 。下列相关化学用语表示正确的是( )
。下列相关化学用语表示正确的是( )
A .  的结构式:
的结构式: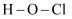 B .
B .  的结构示意图:
的结构示意图: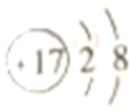 C . 中子数为20的氯原子:
C . 中子数为20的氯原子: D .
D .  的电子式:
的电子式:
 的结构式:
的结构式: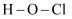 B .
B .  的结构示意图:
的结构示意图: D .
D .  的电子式:
的电子式:
化学用语是国际通用的化学语言,下列化学用语的表示错误的是( )
A . IBr的电子式: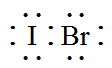 B . 硫离子的结构示意图:
B . 硫离子的结构示意图: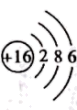 C . 33号元素As的原子结构示意图:
C . 33号元素As的原子结构示意图: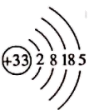 D . 碳正离子
D . 碳正离子 中质子数与电子数的比值为9∶8
中质子数与电子数的比值为9∶8
近年,我国科学家通过热磷化法制备出了电催化分解水的催化剂Co-Fe-P和Ni-Fe-P等过渡金属磷化物,将推动电解水制氢技术的快速发展。回答下列问题:
-
(1) 铁元素在元素周期表中的位置,Fe3+的价电子排布式。
-
(2) 磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因
卤化磷
熔点/K
沸点/K
PF3
121.5
171.5
PCl3
161
348.5
PBr3
233
451.2
PI3
334
573
-
(3) 磷酸具有很强的配位能力,PO
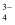 的中心原子杂化类型为,写出与PO
的中心原子杂化类型为,写出与PO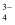 互为等电子体的一种分子
互为等电子体的一种分子
-
(4) 钴的配合物种类很多,如[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl等,[Co(NO2)(NH3)5]2+的配位数是,其配体中的NH3的分子空间构型为;等物质的量的[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl分别与足量的硝酸银溶液反应,两者生成氯化银的质量比为。
-
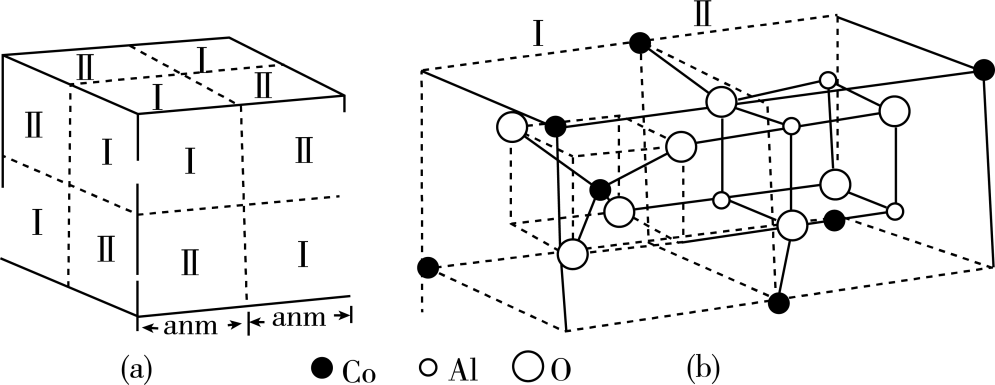
(5) 钴蓝晶体结构如图(a)所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,求晶体的化学式为,密度为g·cm-3。
下列说法或化学用语表述正确的是( )
A . 铍原子最外层电子的电子云轮廓图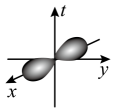 B . Se的核外电子排布式
B . Se的核外电子排布式 C .
C .  的价电子的轨道表示式:
的价电子的轨道表示式: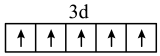 D . 氯化铯的分子式为:CsCl
D . 氯化铯的分子式为:CsCl
 B . Se的核外电子排布式
B . Se的核外电子排布式 C .
C .  的价电子的轨道表示式:
的价电子的轨道表示式:最近更新



