2.1 以食盐为原料的化工产品 知识点题库
海洋是一个巨大的化学资源宝库.海水综合利用的部分流程如下:

已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
-
(1) 电解饱和NaCl溶液的离子方程式为,粗盐中常含Ca2+、Mg2+、SO42﹣等杂质离子,可依次加入NaOH溶液、、、稀盐酸来进行提纯.
-
(2) 下列方法可用于海水淡化的是 (填字母)A . 蒸馏法 B . 萃取法 C . 过滤法
-
(3) 工业上用电解法制Mg时,通常在MgCl3中加入CaCl2 , 其原因是:①增加电解质的密度,便于分离出熔融的镁:②
-
(4)
用母液(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)提取溴,其生产流程如下:
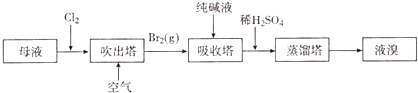
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为.
②母液中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液.
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
-
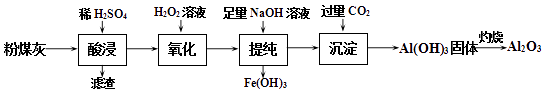
(1) “酸浸”时需加入过量的稀硫酸,目的是提高浸取率和;滤渣的主要成分是。
-
(2) “氧化”过程中,加入H2O2发生反应的离子方程式为。
-
(3) “提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=。
-
(4) 已知Ksp[Fe(OH)3]=1×10-39。“提纯”过程中,当c(Fe3+)<10-6 mol ·L-1时,溶液中c(OH-)>mol ·L-1。
-
(5) “沉淀”过程中,通入过量CO2时发生反应的化学方程式为。
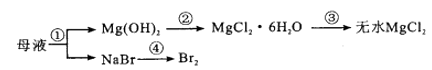
 振荡用分液漏斗分液
过滤。合理的操作顺序是()
振荡用分液漏斗分液
过滤。合理的操作顺序是()
|
|
|
|
A.制蒸馏水 | B.油、水分离 | C.沙、水分离 | D.干燥NH3 |
| 选项 | 目 的 | 分离方法 | 原 理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离汽油和四氯化碳 | 分液 | 四氯化碳和汽油的密度不同 |
| C. | 除去KNO3固体中混杂的NaCl | 结晶 | NaCl在水中的溶解度很大 |
| D. | 除去乙醇中的水 | 蒸馏 | 乙醇与水的沸点相差较大 |
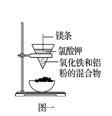 B . 图二:海水淡化的蒸馏操作中缺少了温度计
B . 图二:海水淡化的蒸馏操作中缺少了温度计 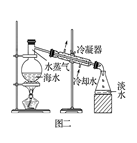 C . 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀
C . 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀  D . 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液
D . 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液 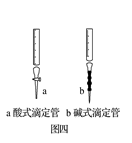

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀 | 2.7 | 7.5 | 4.4 |
| 完全沉淀 | 3.7 | 9.7 | 6.7 |
请回答:
-
(1) 溶液B中含有的阳离子有(填离子符号)。
-
(2) 下列物质中最适宜做氧化剂X的是(填字母)。
a.NaClO b.H2O2 c.KMnO4
-
(3) 加入试剂①是为了调节pH,要调整pH范围是,则试剂①可以选择(填化学式)。
-
(4) 沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉,其原因是(用离子方程式表示)。
-
(5) 溶液E经过操作①可得到胆矾,操作①为、过滤、洗涤。
-
(6) 已知溶液中c(Cu2+)与pH的关系为lgc(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1mol/L,此时溶液中的Fe3+能否沉淀完全:(填“能”或“否”) 。
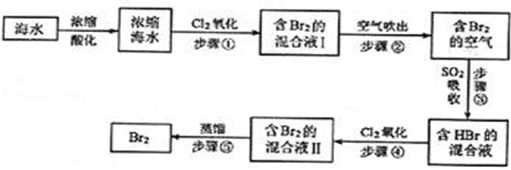
请回答下列问题.
-
(1) 将海水浓缩的方法是;
-
(2) 步骤①反应的离子方程式是,1molCl2参加反应,转移电子mol;
-
(3) 步骤②通入热空气吹出Br2 , 利用了Br2的______(填序号);A . 氧化性 B . 还原性 C . 挥发性 D . 腐蚀性
-
(4) 步骤③中用SO2的水溶液吸收Br2 , 吸收率可达95%,该反应的氧化剂是,在工业生产中此步骤应解决的问题是.
 B . 过滤得含I-溶液
B . 过滤得含I-溶液  C . 从下端放出碘的苯溶液
C . 从下端放出碘的苯溶液  D . 分离碘并回收苯
D . 分离碘并回收苯 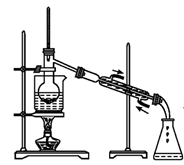
| 选项 | A | B | C | D |
| 实验 | 用CCl4提取溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L−1 K2Cr2O7溶液 |
| 装置或仪器 | | | | |
 ,电离过程为H2SO3= 2H+ + SO
,电离过程为H2SO3= 2H+ + SO  B . 在SO2溶解的过程中,SO
B . 在SO2溶解的过程中,SO  可以被海水中的溶解氧氧化为SO
可以被海水中的溶解氧氧化为SO  ,海水的 pH会升高
C . 为调整海水的pH,可加入新鲜的海水,使其中的HCO
,海水的 pH会升高
C . 为调整海水的pH,可加入新鲜的海水,使其中的HCO  参与反应,其反应的离子方程式是HCO
参与反应,其反应的离子方程式是HCO  + H+ =CO2↑+ H2O
D . 在海水吸收SO2的过程中,体现了SO2的氧化性
+ H+ =CO2↑+ H2O
D . 在海水吸收SO2的过程中,体现了SO2的氧化性
 、
、  和
和 
A | B | C | D |
|
|
|
|
烧杯 | 酒精灯 | 坩埚 | 漏斗 |
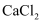 具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量
具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量 、
、 、
、 、
、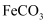 等杂质)生产无水氯化钙的主要流程如下:
等杂质)生产无水氯化钙的主要流程如下:
-
(1) 为了提高步骤①的反应速率,可以采取的措施是。
-
(2) 加入试剂b的目的是使溶液酸化,试剂b可以选择____(选填字母)试剂。A . 硫酸 B . 硝酸 C . 氢硫酸 D . 盐酸
-
(3) 写出步骤②的离子方程式:。
-
(4) 步骤⑤涉及的操作方法有蒸发浓缩、。
-
(5) 已知
 、
、 、
、 生成氢氧化物沉淀或沉淀溶解的pH如下:
生成氢氧化物沉淀或沉淀溶解的pH如下: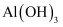



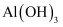
开始沉淀
3.7
6.5
1.5
12.4
开始溶解
7.8
沉淀完全
5.3
9.7
3.3
13.8
完全溶解
10.0
可以通过加入试剂a调节溶液Ⅱ的pH,调节溶液Ⅱ的pH的目的是,调节pH的范围为。
-
(6) 已知某一温度时
 , 向
, 向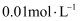 的
的 溶液中加入NaOH固体,假设溶液的体积不变,要使
溶液中加入NaOH固体,假设溶液的体积不变,要使 沉淀完全,溶液中
沉淀完全,溶液中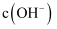 最小为
最小为 。
。
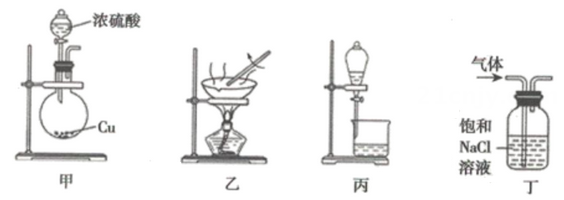
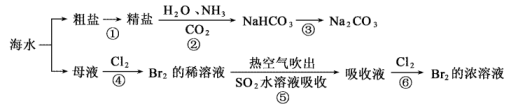
完成下列填空:
-
(1) 写出步骤③的化学方程式:。
-
(2) 工业上用Cl2与KOH(热溶液)制备KClO3 , 反应如下:Cl2+KOH→KCl+KClO3+H2O(未配平)上述反应中氧化剂与还原剂的物质的量之比为:。
-
(3) 下列说法错误的是
a.步骤④中实验室制取氯气的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。b.步骤②既是离子反应又是氧化还原反应
c.步骤⑤中每有1mol SO2参加反应生成1mol SO
 转移2NA个电子。
转移2NA个电子。d.第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
-
(4) 已知氨气极易溶于水,水溶液呈碱性,CO2在水中的溶解度不大,步骤②是在饱和食盐水中先通入NH3再通入CO2 , 原因是。
-
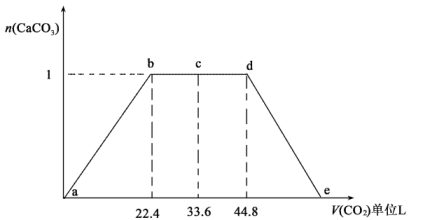
(5) 某同学将CO2通入500mlNaOH与Ca(OH)2的混合溶液中,通入CO2的体积(已换算成标况)与沉淀的量如图所示,写出c-d段发生的离子反应方程式:。由图可知混合溶液中NaOH的物质的量浓度为。