2.1 以食盐为原料的化工产品 知识点题库
完成下列填空:
-
(1) 步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在 (填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是
-
(2)
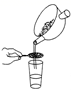
步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I﹣ , 制得富碘溶液.实验室模拟氧化过程的实验装置如图所示.
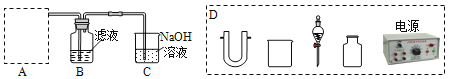
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl﹣;二是电解法.限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是 (选填编号).
a.2NaCl(s)+MnO2+2H2SO4(浓)
 MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2Ob.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O
 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑d.4HCl(浓)+MnO2
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O广口瓶B中发生反应的离子方程式是 .装置C中NaOH的作用是
-
(3)
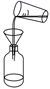
步骤三:取100mL B中富碘溶液,按如下流程分离碘单质.
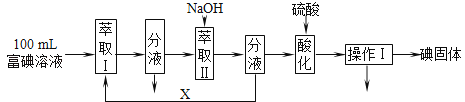
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH﹣→5I﹣+IO3﹣+3H2O;
5I﹣+IO3﹣+6H+→3I2+3H2O;
萃取剂X应选择 (选填编号).
a.100mL苯b.10mL乙醇c.10mLCCl4d.10mL己烯
实验室进行萃取操作的仪器是 .操作Ⅰ的名称是 .
-
(4) 分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:
①要用到的化学试剂是 (填写化学式);
②要测定的物理量是
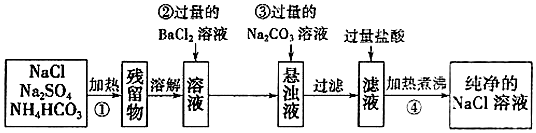
-
(1) 操作①中发生反应的化学方程式是.(已知NH4HCO3受热后没有固体剩余,产生的气体中有一种能使红色石蕊试纸变蓝)
-
(2) 操作②中BaCl2溶液能否改用硝酸钡溶液(填“能”或“不能”).如果能,下一空不需要回答;如果不能,请说明理由:.
-
(3) 操作③的目的是;请你用实验方法确认操作③中碳酸钙碳酸钙已过量:.
-
(4) 操作④的目的是.

请回答下列问题:
-
(1) 写出沉淀中所含物质的化学式:,①中加入的过量试剂为.
-
(2) 上述流程中,加入过量稀盐酸的目的是.
-
(3) 操作Ⅰ、Ⅱ中均需使用的玻璃仪器是,该仪器在操作Ⅰ、Ⅱ中的作用分别是:Ⅰ,Ⅱ.

-
(1) Ⅰ用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈色;打开分液漏斗活塞,却未见液体流下,原因可能是。

-
(2) Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。
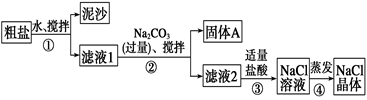
请回答下列问题:
步骤①和②的操作名称是。
-
(3) 步骤③判断加入盐酸“适量”的方法是;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
-
(4) 猜想和验证:
猜想
验证的方法
现象
结论
猜想Ⅰ:固体A中含CaCO3、MgCO3
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口
猜想Ⅰ成立
猜想Ⅱ:固体A中含BaCO3
取少量固体A于试管中,先滴入,再滴入Na2SO4溶液
有气泡放出,无白色沉淀
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4
取少量NaCl晶体溶于试管中的蒸馏水,
猜想Ⅲ成立
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液.
错误的操作顺序是( )
| 选项 | 生产活动 | 化学原理 |
| A | 用聚乙烯塑料制作食品保鲜膜 | 聚乙烯燃烧生成 |
| B | 利用海水制取溴和镁单质 | |
| C | 利用氢氟酸刻蚀石英制作艺术品 | 氢氟酸可与 |
| D | 公园的钢铁护栏涂刷多彩防锈漆 | 钢铁与潮湿空气隔绝可防止腐蚀 |
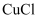 )是一种难溶于水的白色物质,主要用于有机合成催化剂以及颜料、防腐等行业。利用废弃的工业铜屑可生产
)是一种难溶于水的白色物质,主要用于有机合成催化剂以及颜料、防腐等行业。利用废弃的工业铜屑可生产 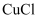 ,制备的工艺流程如图所示:
,制备的工艺流程如图所示: 
已知水溶液中存在平衡: 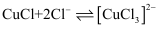 ,下列说法正确的是( )
,下列说法正确的是( )
 ,且需加热
C . “滤渣”的成分只能是铜粉
D . “一系列操作”为过滤、洗涤、干燥
,且需加热
C . “滤渣”的成分只能是铜粉
D . “一系列操作”为过滤、洗涤、干燥

回答下列问题:
-
(1) 实验室中由粗盐制取精盐的过程中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是。
-
(2) 电解饱和食盐水的离子方程式为。
-
(3) 在溴工业中富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为。
-
(4) 镁工业为使苦卤中的Mg2+完全转化为Mg(OH)2(离子浓度小于10-5 mol·L-1时,沉淀就达完全),溶液的pH至少要控制在[常温下,Mg(OH)2的Ksp≈1×10-11];Mg(OH)2沉淀完全后,过滤,沉淀用盐酸酸化,从MgCl2溶液制得无水MgCl2 , 应如何操作。
-
(5) 海水中也有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如下图所示:
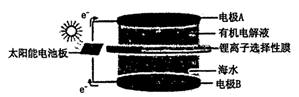
①金属锂在电极(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是。
A.冷水浸泡 | B.加热煎制 | C.箅渣取液 | D.灌装保存 |
|
|
|
|
 Li2S +4H2O。已知:Li2S易潮解,在加热条件下易被空气中的O2氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备H2。
Li2S +4H2O。已知:Li2S易潮解,在加热条件下易被空气中的O2氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备H2。

请回答下列问题:
-
(1) 按气流从左至右,装置的连接顺序是A→ (填字母)。
-
(2) 其他条件相同,粗锌与稀硫酸反应比纯锌 (填“快"或“慢”)。实验中观察到装置D中产生黑色沉淀,其离子方程式为。
-
(3) 利用装置A制氢气的主要优点是,还可用该装置制备的下列气体是 (填字母)。
A.SO2:70%硫酸、亚硫酸钠粉末 B.CO2:稀盐酸、大理石
C.NH3:浓氨水生石灰 D.Cl2:浓盐酸、二氧化锰
-
(4) 实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾(ZnSO4·7H2O)晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。
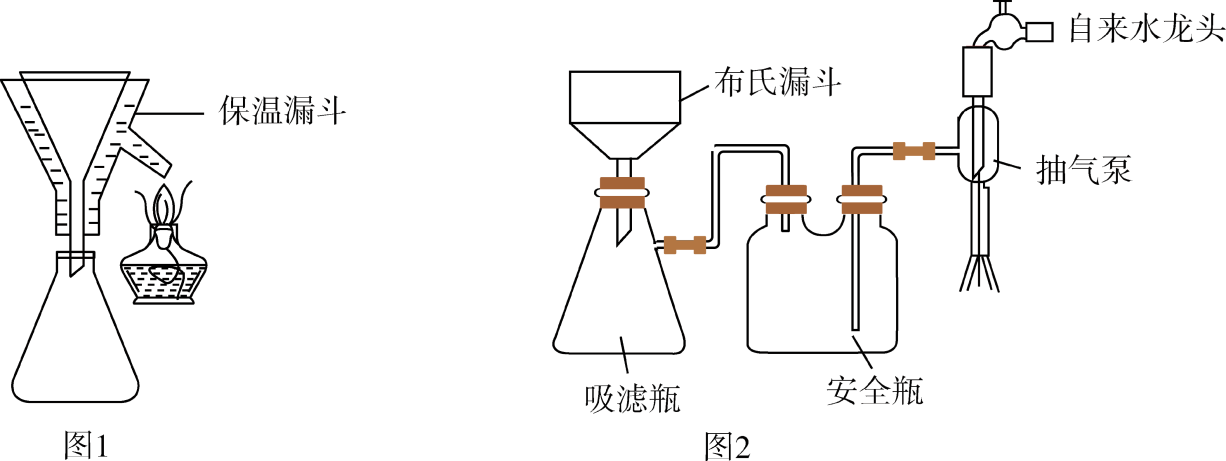
下列有关说法正确的是____(填字母)。
A . 采用图1装置过滤的优点是避免析出ZnSO4·7H2O B . 采用图1装置过滤主要是分离FeSO4·7H2O和ZnSO4溶液 C . 粗皓矾晶体中可能含少量CuSO4·5H2O杂质 D . 采用图2装置过滤的优点是过滤速度快 -
(5) 欲探究Li2S产品的成分,现进行如下实验:
实验
操作与现象
结论
Ⅰ
取少量Li2S样品,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色
样品含Li2SO3
Ⅱ
在实验Ⅰ的溶液中滴加BaCl2溶液,产生白色沉淀
样品含
①由上述实验I可知,Li2S样品中含有杂质(填化学式),产生该杂质的原因可能是。
②测定产品纯度的方法:取w g Li2S样品加入V1 mLc1 mol·L-1稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体;滴加酚酞溶液作指示剂,用c2mol·L-1标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液V2 mL。若该Li2S样品中杂质不参加反应,用上述方法测得的Li2S样品的纯度为%(用含V1、V2、c1、c2、w的代数式表示)。
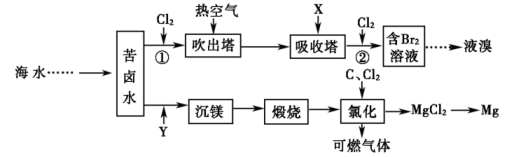
下列说法错误的是( )
 MgCl2+CO
MgCl2+CO
-
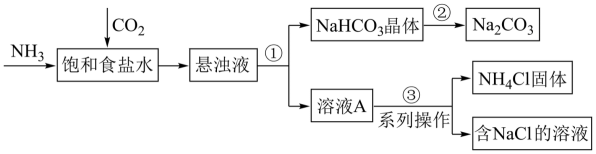
(1) 步骤①②③中涉及“过滤”操作的是(填序号)。
-
(2) 向饱和食盐水中通入
 和
和 后,生成
后,生成 的化学方程式是。
的化学方程式是。
-
(3) 从步骤①中分离出的
 晶体表面含有的杂质可能是和,欲得到纯净的
晶体表面含有的杂质可能是和,欲得到纯净的 , 需将其、干燥。判断
, 需将其、干燥。判断 固体已经纯净的操作和现象是。
固体已经纯净的操作和现象是。
 和
和 
 可被氧化、
可被氧化、  可被还原
可被还原 反应
反应