第三节 氧化还原反应 知识点题库
-
(1) 干法制备高铁酸钠的主要反应为:2FeSO4 + aNa2O2 =2Na2FeO4 + bX + 2Na2SO4 + c O2↑
①该反应中物质 X 应是,a 与 c 的关系是。
②简要说明 K2FeO4 作为水处理剂时,在水处理过程中所起的作用。
-
(2) 湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题。
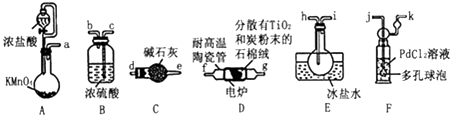
已知:
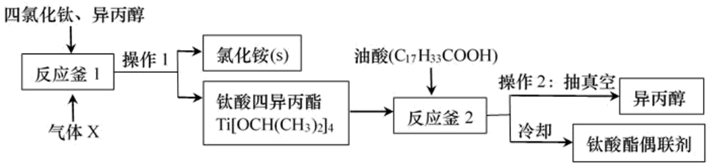
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②TiCl4的制备需无水无氧且加热。
③
化合物 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
TiCl4 | -25 | 136.4 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水,与TiCl4互溶 |
请回答下列问题:
-
(1) 装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为。
-
(2) 按照气流由左到右的方向,上述装置合理的连接顺序为a→→→f→g→→→→→(填仪器接口字母)。
-
(3) 根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;(按符合题意的顺序填入下列操作的序号)。
①加热装置D中陶瓷管 ②打开分液漏斗活塞
③停止加热,充分冷却 ④关闭分液漏斗活塞
实验时,当观察到时,开始进行步骤①。
-
(4) 设计实验证明装置E中收集到的液体中含有TiCl4:。
-
(5) 装置F中发生反应的化学方程式为。
-
(6) 制得的TiCl4产品中常含有少量CCl4 , 从产品中分离出TiCl4的操作名称为。
-
(1) 写出元素D在元素周期表中的位置:。
-
(2) B,C,D三种元素的最简单氢化物的稳定性由强到弱的顺序是(填化学式)。
-
(3) A,B,C,D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:。
-
(4) ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED2与5 mol C2A4恰好完全反应,请写出反应的化学方程式:;若反应消耗1 mol C2A4 , 则转移电子的物质的量为。
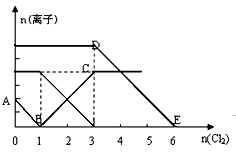
则有关说法错误的是( )
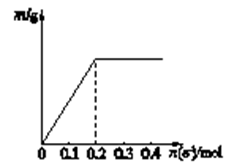

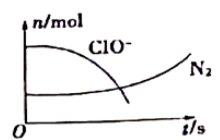
-
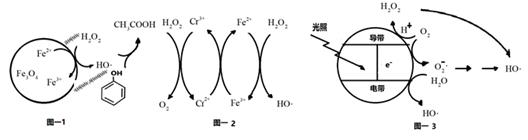
(1) H2O2在Fe3O4催化剂表面产生HO除去废水中的苯酚的原理如图-1所示。
①酸性条件下,该催化过程中产生HO的反应的离子方程式为。
②在不同初始pH条件下,研究苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是。
-
(2) 掺杂了Cr3+的Fe3O4催化剂催化氧化原理如图-2所示。在Fe3O4催化剂中掺杂少量Cr3+ , 可提高催化效率,但浓度太高,反而会降低催化效率,其原因是。
-
(3) 光催化氧化技术也可生成HO降解有机污染物。其原理如图-3.光照时,价带失去电子产生有强氧化性的空穴。价带上生成HO的电极反应式为。图中,HO还有另外的产生途径,描述其产生过程:。
 ),在自然界中主要以金红石(
),在自然界中主要以金红石(  )的形式存在。由于金红石熔点高,为金属
)的形式存在。由于金红石熔点高,为金属  的直接制备带来了困难。在工业上常常采用将其先转化成熔沸点较低的
的直接制备带来了困难。在工业上常常采用将其先转化成熔沸点较低的  后再进行还原的方法。金红石转化成
后再进行还原的方法。金红石转化成  的反应方程式如下:
的反应方程式如下: 
-
(1) 用单线桥法标出电子转移的数目和方向;
-
(2) 指出该反应的氧化剂,氧化产物。
 入氧化剂才能发生的是( )
入氧化剂才能发生的是( )
 B .
B . 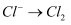 C .
C .  D .
D . 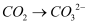
-
(1)
 中铁元素的化合价是。
中铁元素的化合价是。
-
(2) 以下物质均为常用的净水剂,其中属于盐的是____。A . 氯气 B . 次氯酸钙 C . 活性炭 D .
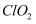 E .
E . 
-
(3) 自来水厂净水过程如图所示。
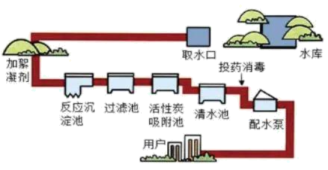
①硫酸铝可用作絮凝剂,其溶于水的电离方程式为。
②活性炭因其具有性,用于去除水中的色素和臭味。另有研究表明,活性炭可用于去除水中多余的氯气,反应生成了氯化氢和二氧化碳,写出该反应的化学方程式,并用单线桥法标明电子转移的方向和数目,该反应中体现了活性炭的性。
③氯气是最早用于饮用水消毒的物质,其在水中发生反应的离子方程式为。
④二氧化氯是一种广谱杀菌剂,在起消毒作用后以
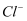 存在于溶液中。若以
存在于溶液中。若以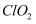 替代
替代 , 提供相同数目的电子,消耗二氧化氯和氯气的物质的量之比为。
, 提供相同数目的电子,消耗二氧化氯和氯气的物质的量之比为。



