第三节 氧化还原反应 知识点题库
下列反应肯定不属于氧化还原反应的是( )
A . 化合反应
B . 分解反应
C . 置换反应
D . 复分解反应
已知(NH4)2SO4在高温下分解,产物是SO2、H2O,N2和NH3 . 有关该反应的下列说法正确的是( )
A . N2既是氧化产物又是还原产物
B . NH4+部分被氧化
C . 氧化产物和还原产物的物质的量比为3:1
D . 氧化产物和还原产物的物质的量比为1:4
已知I﹣、Fe2+、SO2、Cl﹣和H2O2均有还原性,它们在酸性溶液中的还原性顺序为:SO2>I﹣>Fe2+>H2O2>Cl﹣ , 则下列反应不可能发生的是( )
A . 2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+
B . 2Fe2++I2═2Fe3++2I﹣
C . I2+SO2+2H2O═H2SO4+2HI
D . H2O2+SO2═H2SO4
某离子反应涉及到H2O、ClO﹣、NH4+、OH﹣、N2、Cl﹣等微粒,其中N2、ClO﹣的物质的量随时间变化的曲线如图所示,下列说法正确的是( )

A . 该反应中Cl﹣为氧化产物
B . 消耗1 mol还原剂,转移6 mol电子
C . 反应后溶液的酸性减弱
D . NH4+被ClO﹣氧化成N2
下列反应中,氧化剂与还原剂物质的量之比为1:2的是( )
A . 3S+6NaOH═2Na2S+Na2SO3+3H2O
B . 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2
C . I2+2NaClO3═2NaIO3+Cl2
D . 4HCl(浓)+MnO2 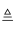 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
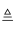 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
Cl2与热的NaOH溶液发生反应:3Cl2+6NaOH═5NaCl+NaClO3+3H2O.关于该反应的说法,正确的是( )
A . Cl2是氧化剂,NaOH是还原剂
B . 每生成1 mol NaClO3转移6 mol电子
C . 还原产物是NaClO3 , 氧化产物是NaCl
D . 被氧化的氯原子与被还原的氯原子个数比为1:5
下列说法不正确的是( )
A . 氧化还原反应的特征是元素化合价发生了变化
B . 在水溶液中能电离出H+的化合物不一定是酸
C . 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42﹣的物质的量相等,则K+和Cl﹣的物质的量浓度一定不相同
D . 因为NH3溶于水的溶液能导电,所以NH3是电解质
某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2 , 下列有关判断正确的是(提示:SOCl2中S显 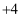 价)( )
价)( )
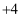 价)( )
价)( )
A . 还原剂只有Li
B . SOCl2既是氧化剂又是还原剂
C . 还原产物包括LiCl和S
D . 生成1.12LSO2时,反应转移电子为0.2mol
四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
-
(1) 实验时在仪器中加试剂前要先。
-
(2) 实验中分液漏斗上口玻璃塞连接导管的作用是 B装置的作用是。
-
(3) 写出D装置中物质制备的化学方程式;写出四氯化钛在空气中发烟的化学方程式。
-
(4) E装置作用是。
-
(5) F装置中盛装的物质是。
-
(6) 该实验设计略有缺陷,请指出其不足之处:。
在xR2+ + yH+ +O2 = mR3+ + nH2O的离子方程式中,对化学计量数m 和R2+、R3+。判断正确的是( )
A . m=y, R3+ 是还原剂
B . m=2y, R2+ 被氧化
C . m=2, R3+ 是氧化剂
D . m=4, R2+ 是还原剂
下列描述中,错误的是( )
A . FeSO4 可用于防止食品氧化变质,延长食品的保质期
B . Fe2O3为红棕色粉末,生活中常用作颜料
C . 向Fe2(SO4)3 溶液中加入足量的铁粉,充分反应后,滴加KSCN溶液,溶液马上变成血红色
D . 铁和水蒸气反应,生成紫黑色的Fe3O4
CuCl常用作催化剂,石油工业中脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。某课外学习小组用辉铜矿(主要成分为Cu2S,少量的Fe2O3和SiO2)制取氯化亚铜的流程如下:

-
(1) “焙烧”过程发生反应的化学方程式;为加快浸取速率常采取的措施(写两条)。
-
(2) 加入“试剂1”可调节浸出液的pH,“试剂1”可以是;“滤渣”的成分是(填化学式)。

-
(3) ①图1是反应体系pH随时间的变化关系图。写出“还原”制备CuCl的离子方程式。
②制备过程中,当n(Na2SO3)与n(CuCl2)比值过大时CuCl产率会变小,其原因可能是。
-
(4) 反应完成后经抽滤、洗涤、干燥获得产品。图2为抽滤”装置,抽气泵可使吸滤瓶和安全瓶内压强减小,与普通过滤相比,采用抽滤的优点是。
-
(5) CuCl沉淀的“洗涤”需要经过酸洗、水洗和醇洗。用“去氧水洗后再用“乙醇”洗涤的原因是。
-
(6) 取1.0g制备的CuCl粉末样品,先加入足量FeCl3溶液使其完全溶解,再稀释到100mL,从中取出25.00mL,用0.1mol·L-1Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce2(SO4)3];三次滴定平消耗标准液的体积为22.00mL。则粉末中CuCl的质量分数为。
已知:① 2FeCl3 + 2KI=2FeCl2 + 2KCl + I2 , ② 2FeCl2+Cl2=2FeCl3。根据①②两式判断各物质的氧化性由强到弱的顺序。( )
A . FeCl3>Cl2>I2
B . Cl2>FeCl3>I2
C . I2>Cl2>FeCl3
D . Cl2>I2>FeCl3
常温时,将0.1 molFe(NO3)3和2molHCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是( )
A . 由于氧化性Fe3+>H+ , 首先发生的反应是:Fe+2Fe3+=3Fe2+
B . 当加入16.8g铁粉时,可生成标准状况下6.72L气体
C . 在铁粉充分反应后的溶液中,溶质含有硝酸亚铁和氯化铁
D . m至少等于28g,反应过程中溶液的质量一直在减小
SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。下列有关说法错误的是( )

A . a极为直流电源的负极,与其相连的电极发生还原反应
B . 阴极得到2mol电子时,通过阳离子交换膜的H+为2mol
C . 吸收池中发生反应的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-
D . 阳极发生的反应式为SO2+2e-+2H2O=SO42-+4H+
下列各组实验中,根据实验现象所得结论正确的是( )
| 选项 | 实验操作和实验现象 | 结论 |
| A | 向 | 氧化性: |
| B | 向盛某盐溶液的试管中滴入浓氢氧化钠溶液并加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含有 |
| C | 将稀盐酸滴入 | 非金属性: |
| D | 将红热的炭放入浓硫酸中,产生的气体通入澄清石灰水,石灰水变浑浊 | 碳被氧化成 |
A . A
B . B
C . C
D . D
氯气有广泛的用途,回答下列问题:
-
(1) 氯气可以用于制备“战略金属”钛,其中有关反应如下,用双线桥(或单线桥)标出反应中电子转移的方向和数目:TiO2+2C+2Cl2
 TiCl4+2CO。
TiCl4+2CO。
-
(2) 反应8NH3+3Cl2=N2+6NH4Cl可用于氯气管道的检漏,在该反应中,N2为产物(填“氧化”或“还原”)
-
(3) 氯气可与NaOH溶液反应制备“84”消毒液,在2020年初抗击新冠病毒感染的肺炎(Covid-19)疫情中,“84”消毒液发挥了重要的作用。但若将“84”消毒液与洗厕剂洁厕灵混合使用,则会产生氯气,其反应的离子方程式是:。
-
(4) 氯气可与水反应,产生有漂白、杀菌作用的物质,反应的离子方程式为;氯气可以用于制备漂白粉,漂白粉的有效成分是 (填化学式)。
-
(5) 实验室检验某溶液中是否含有Cl-的操作方法是:。
四个基本反应中一定属于氧化还原反应的是( )
A . 化合反应
B . 分解反应
C . 复分解反应
D . 置换反应
磷化氢(PH3)是一种在空气中能自燃的剧毒气体,可通过以下流程制取:

下列说法错误的是( )
A .  既能与酸反应又能与碱反应
B . 流程中有两处涉及氧化还原反应
C . 该过程需要在无氧条件下进行
D . 分解反应生成
既能与酸反应又能与碱反应
B . 流程中有两处涉及氧化还原反应
C . 该过程需要在无氧条件下进行
D . 分解反应生成  和
和  的物质的量之比为1∶1
的物质的量之比为1∶1
 既能与酸反应又能与碱反应
B . 流程中有两处涉及氧化还原反应
C . 该过程需要在无氧条件下进行
D . 分解反应生成
既能与酸反应又能与碱反应
B . 流程中有两处涉及氧化还原反应
C . 该过程需要在无氧条件下进行
D . 分解反应生成  和
和  的物质的量之比为1∶1
的物质的量之比为1∶1
科学家发明了一种硫自养生物反应装置,该装置可将酸性废水中 还原为更易被去除的
还原为更易被去除的 , 其反应机理如图。下列说法正确的是 ( )
, 其反应机理如图。下列说法正确的是 ( )
 还原为更易被去除的
还原为更易被去除的 , 其反应机理如图。下列说法正确的是 ( )
, 其反应机理如图。下列说法正确的是 ( )
A . 该过程可以实现S单质的循环利用
B . 反应①的离子方程式为: C . 生成
C . 生成 时,转移
时,转移 D . 生成
D . 生成 参加反应的S中氧化剂与还原剂物质的量比为3∶1
参加反应的S中氧化剂与还原剂物质的量比为3∶1
 C . 生成
C . 生成 时,转移
时,转移 D . 生成
D . 生成 参加反应的S中氧化剂与还原剂物质的量比为3∶1
参加反应的S中氧化剂与还原剂物质的量比为3∶1
最近更新
 和
和 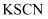 的混合溶液中滴入酸化的
的混合溶液中滴入酸化的  溶液,混合溶液变红
溶液,混合溶液变红

 溶液中,溶液中出现凝胶
溶液中,溶液中出现凝胶




