第三节 氧化还原反应 知识点题库
下列有关物质的性质或结构的说法正确的是( )
A . 第二周期元素最高价与其原子最外层电子数相等
B . Na的原子半径比Cl的大,但Na+的半径比Cl-的小
C . Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱
D . Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4
保险粉学名“连二亚硫酸钠”,但实际上是不“保险”的,属于一级遇湿易燃物品,遇水后可发生剧烈反应:2Na2S2O4+2H2O+O2===4NaHSO3。在该反应中Na2S2O4表现( )
A . 氧化性
B . 还原性
C . 既表现氧化性又表现还原性
D . 既不表现氧化性也不表现还原性
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3 .
A . H2SO3>I﹣>Fe2+>NO
B . I﹣>Fe2+>H2SO3>NO
C . Fe2+>I﹣>H2SO3>NO
D . NO>Fe2+>H2SO3>I﹣
新一代饮用水的消毒剂ClO2具有高效、广谱、安全等特点.制取ClO2的其中一种反应是:Cl2+2NaClO2═2ClO2+2NaCl.则下列叙述正确的是( )
A . 该反应是复分解反应
B . 该反应1molCl2得到2mole﹣
C . 反应中Cl2既是氧化剂,又是还原剂
D . NaClO2和ClO2中Cl的化合价相同
海带中含有丰富的碘元素,在实验室中,我们可以用海带通过多步实验制成碘水,下列说法正确的是( )
A . 该实验过程中要用到氧化剂
B . 检验碘单质是否存在,可用碘化钾溶液
C . 要萃取碘水中的碘,可以用汽油或酒精
D . 利用如图所示装置不能分离食盐和晶体碘的混和物

下列物质中,不能通过单质化合反应直接生成的是
A .  B .
B .  C .
C .  D .
D . 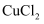
 B .
B .  C .
C .  D .
D . 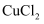
下列有关氧化还原反应的说法正确的是( )
A . 氧化还原反应的本质是电子的转移,特征是化合价的升降
B . 复分解反应一定不是氧化还原反应,分解反应和化合反应一定是氧化还原反应
C . 氧化还原反应中如有一种元素被氧化,则一定有另一种元素被还原
D . 某元素由化合态转化为游离态,则该元素一定被氧化了
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
-
(1) 人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述错误的是________(填选项字母)。A . 亚硝酸盐被还原 B . 维生素C是还原剂 C . 维生素C将Fe3+还原为Fe2+ D . 亚硝酸盐是还原剂
-
(2) 下列方法中,不能用来区分NaNO2和NaCl的是________(填选项字母)。A . 测定这两种溶液的pH B . 分别在两种溶液中滴加甲基橙 C . 在酸性条件下加入淀粉KI溶液来区别 D . 用AgNO3和HNO3两种试剂来区别
-
(3) 某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:。
-
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是________(填选项字母)。A . Cl2 B . Fe C . H2O2 D . HNO3
-
(5) 当FeSO4和O2的化学计量数之比为2∶1,试配平下列方程式:
__FeSO4+__K2O2=_K2FeO4+__K2O+__K2SO4+__O2↑。
某兴趣小组探究SO2气体还原Fe3+ , 他们使用的药品和装置如图所示:

下列说法不合理的是( )
A . 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B . 装置C的作用是吸收SO2尾气,防止污染空气
C . 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2 , 产生白色沉淀
D . 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A . KClO3在反应中得到电子
B . ClO2是氧化产物
C . H2C2O4在反应中被还原
D . 1mol KClO3参加反应有2 mol电子转移
根据反应:O2+2H2S=2S↓+2H2O,Na2S+I2=2NaI+S↓,4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,判断下列物质的氧化性强弱,正确的是( )
A . O2>I2>S
B . H2S>NaI>H2O
C . S>I2>O2
D . H2O>NaI>H2S
酒后驾车是马路第一杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生反应: 2K2Cr2O7+ 3C2H5OH+
8H2SO4=2K2SO4+ 2Cr2(SO4)3+
3CH3COOH+ 11H2O, 且知  和Cr3+在溶液中分别显橙色和绿色。回答下列问题:
和Cr3+在溶液中分别显橙色和绿色。回答下列问题:
 和Cr3+在溶液中分别显橙色和绿色。回答下列问题:
和Cr3+在溶液中分别显橙色和绿色。回答下列问题:
-
(1) 该反应(填 “是”或“不是”)离子反应。.
-
(2) 将上述化学方程式改写成离子方程式。
-
(3) 该反应(填“是”或“不是”)氧化还原反应,判断的依据是。
-
(4) 能否用这一反应来检测司机是否酒后驾车 (填“能” 或“否”),理由是。
化学反应中常伴有颜色变化,下列描述颜色变化的化学方程式错误的是( )
A .  通入
通入  溶液产生无色气体:
溶液产生无色气体:  B .
B . 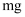 在
在  中燃烧产生白色和黑色固体:
中燃烧产生白色和黑色固体:  C . 向
C . 向  溶液中加入少量Zn粉,溶液黄色褪去:
溶液中加入少量Zn粉,溶液黄色褪去:  D . 将表面覆盖黑色
D . 将表面覆盖黑色  的银器放入盛装食盐水的铝锅中煮沸后,银器重新变光亮:
的银器放入盛装食盐水的铝锅中煮沸后,银器重新变光亮: 

 通入
通入  溶液产生无色气体:
溶液产生无色气体:  B .
B . 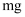 在
在  中燃烧产生白色和黑色固体:
中燃烧产生白色和黑色固体:  C . 向
C . 向  溶液中加入少量Zn粉,溶液黄色褪去:
溶液中加入少量Zn粉,溶液黄色褪去:  D . 将表面覆盖黑色
D . 将表面覆盖黑色  的银器放入盛装食盐水的铝锅中煮沸后,银器重新变光亮:
的银器放入盛装食盐水的铝锅中煮沸后,银器重新变光亮: 

利用图示装置进行实验,能得出相应结论的是( )
| 溶液甲 | 固体乙 | 溶液丙 | 实验结论 | | |
| A | 浓硝酸 | Na2CO3 | Na2SiO3 | 非金属性:N>C>Si | |
| B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
| C | 浓硫酸 | Na2SO3 | 溴水 | SO2具有漂白性 | |
| D | 浓氨水 | 碱石灰 | 酚酞 | NH3.H2O是弱碱 |
A . A
B . B
C . C
D . D
用丙醛CH3CH2CHO制取聚丙烯  的过程中发生的反应类型为( )
的过程中发生的反应类型为( )
①取代反应;②消去反应;③加聚反应;④还原反应;⑤氧化反应
A . ④②③
B . ⑤②③
C . ①④③
D . ②④⑤
下列反应的离子方程式书写错误的是( )
A . 向硫酸铜水溶液中逐渐滴加氨水形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,蓝色沉淀溶解的离子方程式 : Cu(OH)2 +4NH3·H2O=[Cu(NH3)4]2+ +2OH-+4H2O
B . 向 FeCl2 溶液中通入少量 Cl2:2Fe2+ + Cl2 =2Fe3+ + 2Cl-
C . Ba(OH)2 溶液与足量的 NaHCO3 溶液反应:Ba2+ +2OH-+2  =BaCO3 ↓+2H2O+
=BaCO3 ↓+2H2O+  D . 向 NaClO 溶液中通入足量的 SO2:SO2+2H2O+ClO-=
D . 向 NaClO 溶液中通入足量的 SO2:SO2+2H2O+ClO-= 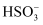 + HClO
+ HClO
 =BaCO3 ↓+2H2O+
=BaCO3 ↓+2H2O+  D . 向 NaClO 溶液中通入足量的 SO2:SO2+2H2O+ClO-=
D . 向 NaClO 溶液中通入足量的 SO2:SO2+2H2O+ClO-= 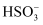 + HClO
+ HClO
下列实验中,依据实验操作及现象得出的结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将少量BaSO4固体用饱碳酸钠溶液浸泡,过滤后向滤渣中加入HCl | 滤渣溶解,并产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
| B | 足量双氧水滴入酸性高锰酸钾溶液中 | 溶液褪色 | H2O2具有漂白性 |
| C | 向溶液X中通入氯化氢气体 | 生成白色沉淀 | 溶液X中一定含有Ag+ |
| D | 常温下,用pH计测定0.1mol•L-1NH4CN溶液的pH | pH=8.6 | 电离平衡常数:K(NH3•H2O)>K(HCN) |
A . A
B . B
C . C
D . D
三效催化剂是最为常见的汽车尾气催化剂,催化剂表面物质转化的关系如图所示,下列说法错误的是( )

A . “还原”过程中碳元素均被氧化
B . “储存”和“还原”过程中氮元素均被还原
C . “储存”过程中每消耗1mol  转移4mol
转移4mol 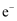 D . 三效催化剂能有效实现汽车尾气中CO、
D . 三效催化剂能有效实现汽车尾气中CO、  、
、  三种成分的净化
三种成分的净化
 转移4mol
转移4mol  D . 三效催化剂能有效实现汽车尾气中CO、
D . 三效催化剂能有效实现汽车尾气中CO、  、
、  三种成分的净化
三种成分的净化
《化学世界》杂志报道,制备磁流体的方法如下:将FeSO4与Fe2(SO4)3等物质的量混合,再加入稍过量的NaOH溶液,即可生成黑色的磁性物质。制备磁流体的离子方程式为Fe2++2Fe3++aOH-=Fe3O4+bH2O(其中a、b为对应化学计量数),下列说法正确的是( )
A . 可以利用磁铁鉴别Fe和Fe3O4
B . 该反应属于氧化还原反应
C . 消耗3molFe2+转移2 mol e-
D . a=8,b=4
下列反应中,不属于氧化还原反应的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
最近更新




