第三节 氧化还原反应 知识点题库
加入溶液 | 1适量铋酸钠溶液 | 2过量的双氧水 | 3适量KI淀粉溶液 |
实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
①粒子半径:S2﹣>Cl>S ②氢化物稳定性:HF>HCl>PH3;
③离子还原性:S2﹣>Cl﹣>Br﹣>I﹣ ④单质氧化性:Cl2>S;
⑤酸性:H2SO4>HClO4 ⑥碱性强弱:KOH>NaOH>Mg(OH)2 .
-
(1) 0.2mol/L Ca(HCO3)2与0.3mol/LNaOH等体积混合
-
(2) 向浓度均为0.2mol/L的NaOH与Na2CO3混合溶液中逐滴滴入等体积的0.3mol/L稀盐酸
-
(3) 向FeI2溶液中通入一定量Cl2 , 其中氧化剂与还原剂物质的量比为4:3
-
(4) 向一定量的浓硝酸中投入适量铁粉并加热,产物中Fe2+与Fe3+的物质的量比为1:1;NO与NO2物质的量比也为1:1.
 )是常用的还原剂。在一定体积的某维生素C(化学式
)是常用的还原剂。在一定体积的某维生素C(化学式  )溶液中加入
)溶液中加入  溶液
溶液 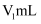 ,使维生素C完全氧化,充分反应后,用
,使维生素C完全氧化,充分反应后,用  溶液滴定剩余的I2 , 消耗
溶液滴定剩余的I2 , 消耗  溶液
溶液  。
。 已知发生的反应为: 
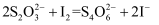 ,该溶液中维生素C的物质的量是mol。写出简要的计算过程。
,该溶液中维生素C的物质的量是mol。写出简要的计算过程。
-
(1) 根据反应回答下列问题:K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
①用双线桥法分析该氧化还原反应(标明得失电子及数目):
K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
②以上反应中还原产物是,氧化剂与还原剂的物质的量之比为。
-
(2) 写出下列化学反应的离子方程式:
①过氧化钠与水反应。
②钠单质与水反应。
③醋酸与氢氧化钾溶液反应。
-
(1) I.汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对其治理具有重要意义。
氧化-还原法消除NOx的转化:NO
 NO2
NO2 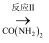 N2
N2①反应I为NO+O3=NO2+O2 , 生成标准状况下11.2 L O2时,转移电子数目为;
②反应II中,当n(NO2):nCO(NH2)2=3:2时,氧化产物与还原产物的质量比为;
-
(2) 吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置II中酸性条件下,NO被Ce4+氧化的产物主要是
 、
、  ,写出生成等物质的量的
,写出生成等物质的量的  和
和  时的离子方程式。
时的离子方程式。 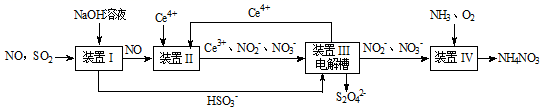
-
(3) 已知进入装置IV的溶液中,NO2的浓度为a g/L,要使1m3该溶液中的
 完全转化为NH4NO3 , 至少需向装置IV中通入标准状况下的氧气L(用含a代数式表示,结果保留整数)。
完全转化为NH4NO3 , 至少需向装置IV中通入标准状况下的氧气L(用含a代数式表示,结果保留整数)。
-
(4) II.镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应剧烈,原因是。
-
(5) 锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的固态化合物,Y、Z与水反应均可放出气体。0.01 mol Y溶于100 mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为,Z的电子式为。
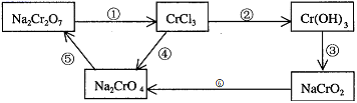
-
(1) 完成方程式,回答相关问题。用单线桥标出反应①的电子转移的方向和数目。
反应①为: Na2Cr2O7 + HCl → NaCl +CrCl3 + Cl2↑+ H2O()
反应⑥为:ClO
 CrO
CrO  +_
+_  →_Cl-+CrO
→_Cl-+CrO 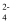 +H2O()
+H2O()反应⑥中还原剂为,还原产物为 。
-
(2) 在上述转化中,需用氧化剂的步骤是(填编号)。
 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
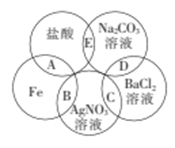
回答下列问题:
-
(1) 反应A,B,C,D,E中属于氧化还原反应的是(填字母)。
-
(2) 根据已学过的知识及这五个反应,比较H+、Fe2+和Ag+的氧化性由强到弱的顺序:。
-
(3) 反应A的离子方程式为。
-
(4) 用双线桥分析反应B的离子方程式:。
-
(5) 已知反应:
 ,该反应的还原产物是(写化学式,下同)。Cl2、NaClO3和ClO2均是常见的氧化剂,其中氧化性最强的是。
,该反应的还原产物是(写化学式,下同)。Cl2、NaClO3和ClO2均是常见的氧化剂,其中氧化性最强的是。
 D . SO3→SO
D . SO3→SO 

下列说法错误的是( )
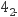 +3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4
+3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4
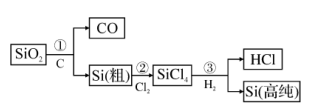
-
(1) 臭氧与空气中的氮氧化物和(填字母)在紫外线照射下产生光化学烟雾。
a.二氧化硫 b.碳氢化合物 c.二氧化碳
-
(2) 汽车排气管内的催化剂能将CO和
 转化为无害气体,发生的反应方程式为。
转化为无害气体,发生的反应方程式为。
-
(3) 工业上在催化剂作用下用
 还原废气中
还原废气中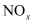 生成
生成 和
和 达到脱除目的,但当温度高于400℃时,
达到脱除目的,但当温度高于400℃时,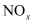 脱除率下降,原因可能是。
脱除率下降,原因可能是。
-
(4) 工业上氮的氧化物通常是用碱性溶液吸收。
①用
 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 , 生成等物质的量的两种钠盐(一种为
, 生成等物质的量的两种钠盐(一种为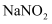 )及一种气体,反应的离子方程式为。
)及一种气体,反应的离子方程式为。②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收
 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如题图所示,曲线II表示NO的物质的量(填:“大于”、“小于”、“等于”)
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如题图所示,曲线II表示NO的物质的量(填:“大于”、“小于”、“等于”) 物质的量:当NaOH溶液浓度高于
物质的量:当NaOH溶液浓度高于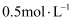 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是。
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是。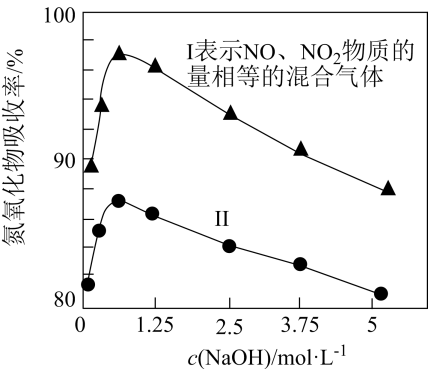
 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下
参与有机合成是实现“碳中和”的途径之一、高温、高压条件下 和
和 可合成尿素
可合成尿素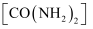 。
。 与苯酚经过一系列反应可制得水杨酸(沸点
与苯酚经过一系列反应可制得水杨酸(沸点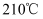 ),水杨酸和甲醇(沸点
),水杨酸和甲醇(沸点 )发生如下反应制取冬青油(沸点
)发生如下反应制取冬青油(沸点 :
: +CH3OH
+CH3OH
 +H2O。下列说法正确的是( )
+H2O。下列说法正确的是( )
 是极性分子
B . 第一电离能:
是极性分子
B . 第一电离能: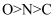 C .
C .  D .
D .  在合成尿素的反应中作氧化剂
在合成尿素的反应中作氧化剂
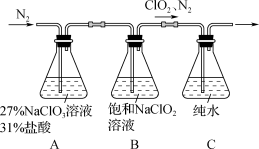
已知装置A中发生的反应:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl(主反应)
NaClO3+6HCl=NaCl+3Cl2↑+3H2O(副反应)
-
(1) 证明装置A中产生Cl2 , 是否可用湿润的淀粉碘化钾试纸:(填“是”或“否”)。
-
(2) Cl2在装置B的反应中主要体现氧化性,该反应的化学方程式为。
-
(3) 实验过程中不断缓慢通入N2的目的是。
-
(4) 单位体积ClO2吸收液中含有ClO2的质量的实验测定步骤如下:
步骤1:准确移取1.00 mL装置C中的吸收液加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+=5I2+2Cl-+4H2O),在暗处放置5 min。
步骤2:向锥形瓶的反应液中加入1 mL溶液(填试剂名称),溶液呈蓝色,再向其中滴加0.08 mol·L-1 Na2S2O3溶液(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),至恰好完全反应时(蓝色褪去)消耗Na2S2O3溶液20.00 mL。
①步骤2中所加试剂名称是;
②计算装置C中,每1.00 mL ClO2吸收液中含有ClO2的质量(单位mg)(写出计算过程)。



