第三节 氧化还原反应 知识点题库
①G→Q+NaCl ②Q+H2O→X+H2 ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
则G,Q,X,Y,Z这五种化合物中氯元素的化合价由低到高的顺序为( )
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
-
(1) 用“双线桥法”标明反应中电子转移的方向和数目.
-
(2) 又已知MnO2+4HCl(浓)
 MnCl2+Cl2+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:.
MnCl2+Cl2+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:.
-
(3) 若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.
①H2SO3+I2+H2O=2HI+H2SO4氧化剂:氧化产物
②4HCl(浓)+MnO2 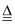 MnCl2+Cl2↑+2H2O,元素化合价升高,发生反应,氧化剂与还原剂的物质的量之比为,若生成标况下4.48L氯气,则转移的电子总数是.用双线桥法表示反应②的电子转移情况.
MnCl2+Cl2↑+2H2O,元素化合价升高,发生反应,氧化剂与还原剂的物质的量之比为,若生成标况下4.48L氯气,则转移的电子总数是.用双线桥法表示反应②的电子转移情况.

下列说法不正确的是
 =
= 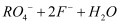 ,由此可知在
,由此可知在  中元素R的化合价是( )
中元素R的化合价是( )

-
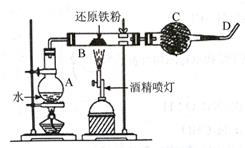
(1) 中通过加热
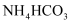 固体来制备氨气,除铁架台
固体来制备氨气,除铁架台 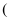 含铁夹
含铁夹  和酒精灯外还需用到的是
和酒精灯外还需用到的是  选填下列仪器编号
选填下列仪器编号  。
。 
-
(2) 补充完整后,有同学认为装置在安全性上还存在缺陷,需要在
 填序号
填序号  连接图所示装置。
连接图所示装置。  之间
之间b.B-C之间
c.C-D之间
d.D之后

按照改进后的装置进行实验,检验气密性后,先将C处的铂丝加热到红热,再将A处气体通过B装置片刻后,撤去C处酒精灯继续反应,可观察到的部分现象为:铂丝保持红热,D中溶液变红。
-
(3) 中所得混合气体通过B后会产生
 ,B中反应的还原剂是。
,B中反应的还原剂是。
-
(4) 写出C中
 与
与  反应的化学方程式,可用于判断该反应是放热还是吸热的实验现象是。
反应的化学方程式,可用于判断该反应是放热还是吸热的实验现象是。
-
(5) 使D中石蕊溶液变红的物质是
 填写化学式
填写化学式  。
。
-
(6) 有同学认为,D中溶液内可能含有
 ,如何检验。
,如何检验。
-
(1) 仪器C的名称为。
-
(2) 该同学据实验得出结论:铁与水蒸气反应生成FeO和H2。该结论不严密,理由是。
-
(3) 经检验,反应生成的固体具有磁性,写出铁与水蒸气反应的化学方程式:。

-
(1) 通入氮气的主要作用有 2 个,一是可以起到搅拌作用,二是;
-
(2) 关于该实验,以下说法正确的是___________。A . 装置 A 用适量 H2O2 制取 ClO2 气体,其反应的化学方程式为2NaClO3+3H2O2+H2SO4=2ClO2↑+Na2SO4+2O2↑+4H2O B . 装置 B 用来收集二氧化氯气体 C . 当看到装置 C 中导管液面上升时应加大氮气的通入量 D . 二氧化氯能杀菌消毒,但不会与有机物发生取代反应

回答下列问题:
-
(1) NaClO3中Cl的化合价为; 写出 NaHSO4在水中的电离方程式: 。
-
(2) 写出“反应”步骤中的化学方程式: 。
-
(3) “吸收”时,氧化剂是,每生成8.96L(标准状况下)O2 , 消耗还原剂的物质的量为mol。
-
(4) “有效氯含量”可用来衡量含氯消毒剂(用R表示)的消毒能力,可用如下公式计算:
 ×氯原子的摩尔质量
×氯原子的摩尔质量则ClO2的有效氯含量为。(计算结果保留两位小数)
已知该反应中H2O2只发生如下过程:H2O2―→O2.
①该反应中的还原剂是.
②该反应中,发生还原反应的过程是→.
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
④如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为
(Ⅱ)已知实验室利用KMnO4溶液和浓盐酸反应制取Cl2 , 请回答下列问题:
①配平此化学方程式:
KMnO4+HCl(浓)— KCl+MnCl2+Cl2↑+H2O
②把此化学方程式改写成离子方程式:
③被氧化的HCl 与未被氧化的HCl物质的量之比为
Ⅰ.H2(g)+ICl(g)=HCl(g)+HI(g)
Ⅱ.HCl(g)+HI(g)+ICl(g)=I2(g)+2HCl(g)
反应过程中的能量变化曲线如图所示,下列有关说法错误的是( )


 的化学反应为
的化学反应为  。下列有关该反应的说法错误的是( )
。下列有关该反应的说法错误的是( )
 在反应中被氧化
B .
在反应中被氧化
B .  在反应中得到电子
C .
在反应中得到电子
C .  在反应中作氧化剂
D . 每消耗
在反应中作氧化剂
D . 每消耗  还原剂,转移
还原剂,转移 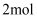 电子
电子

根据上述流程图回答下列问题:
-
(1) 海水淡化处理的方法有蒸馏法、冷冻法、。(写出1种即可)
-
(2) 写出反应①化学方程式:
-
(3) 标准状况下
 发生反应②,转移的电子数是
发生反应②,转移的电子数是 。
。
-
(4) 过程③到过程⑤的变化为“
 ”,其目的是。
”,其目的是。
-
(5) 写出过程④的离子方程式:。
-
(6) 空气吹出碱液吸收法的生产过程类似于酸法制溴,只是吸收与蒸馏环节不同,其流程如图:

写出③酸化过程中的离子方程式:。



