实验活动2 铁及其化合物的性质 知识点题库
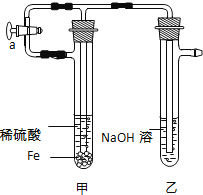
(1)将实验所需的稀硫酸和氢氧化钠溶液加热煮沸,其目的是 .
(2)按图所示连接好装置,打开止水夹a,反应片刻后,夹紧止水夹a,此时可观察到的现象是 ;乙中发生反应的离子方程式是 .
(3)将试管乙中的混合物倒入表面皿中,可观察到的现象 ;反应的化学方程式是 .
-
(1) 将FeCl3溶液滴入沸水可以制得Fe(OH)3胶体。鉴别Fe(OH)3胶体和FeCl3溶液的方法是。
-
(2) 胶体区别于其他分散系的本质特征是。
-
(3) 人体不易吸收三价铁,所以常用硫酸亚铁治疗缺铁性贫血。解释补铁的同时服用维生素C的原因。
-
(4) 电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式。
-
(5)
工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
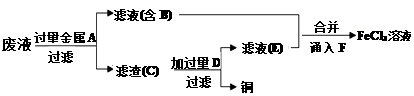
根据上述设计方案并结合所学知识回答以下问题。
检验滤液E中金属阳离子的方法是。
-
(6) 通入F发生反应的离子方程式为。
 已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀
已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀  ,则下列叙述正确的是( )
,则下列叙述正确的是( )
-
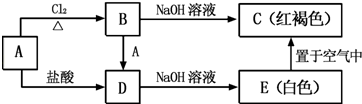
(1) 写出A、C的化学式:A;C.
-
(2) 检验B中阳离子的试剂是.
-
(3) 写出下列反应的化学方程式或离子方程式:
A→D 的离子方程式
E→C 的化学方程式
选项 | 操 作 | 现 象 | 结 论 |
A | 先向待测液滴加BaCl2溶液,再滴足量的盐酸 | 生成白色沉淀,加酸后沉淀不溶解 | 原溶液中有SO42- |
B | 先向待测液滴加2滴KSCN溶液,再滴几滴新制的氯水 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有Fe2+ |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+ , 无K+ |
D | 将有色布条放入盛有干燥氯气的集气瓶中并盖上玻璃片 | 有色布条褪色 | 氯气有漂白性 |
| 选项 | 实验 | 现象 | 结论 |
| A | 向AgCl悬浊液中加入KI溶液,振荡 | 沉淀由白色变为黄色 | AgCl溶解度大于AgI |
| B | 向2mL0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: Kh(CH3COO-)<Kh(HCO3-) |
| D | 常温时,用两支试管各取4mL 0.1mol/L 酸性KMnO4溶液,分别加入0.1mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2mol/L H2C2O4 溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
| 现象或操作 | 解释 | |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去 | SO2具有漂白性 |
| B | 配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe3+水解,并防止Fe3+变质 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 向含有Cu(OH)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀 | Ksp(Ag2S)<Ksp(CuS) |
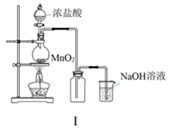 图I:若MnO2过量,则浓盐酸就可全部消耗
B .
图I:若MnO2过量,则浓盐酸就可全部消耗
B . 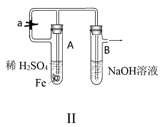 图Ⅱ:可利用该装置制备Fe(OH)2并较长时间保持颜色不变
C .
图Ⅱ:可利用该装置制备Fe(OH)2并较长时间保持颜色不变
C . 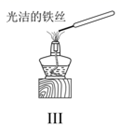 图Ⅲ:可利用该实验直接观察纯碱中钠元素的焰色反应
D .
图Ⅲ:可利用该实验直接观察纯碱中钠元素的焰色反应
D . 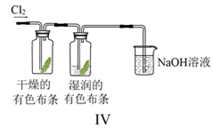 图Ⅳ:利用该实验装置可证明起漂白作用的不是Cl2
图Ⅳ:利用该实验装置可证明起漂白作用的不是Cl2
-
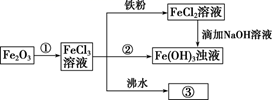
(1) 请写出 Fe2O3 与物质①反应的离子方程式:。
-
(2) 检验溶液中 Fe3+是否存在的试剂是(只写一种即可)。
-
(3) 写出铁与 FeCl3 溶液反应的离子方程式:。
-
(4) 向FeCl2 溶液中滴加NaOH 溶液最终生成Fe(OH)3 浊液,该过程的现象为,此过程中 Fe(OH)2 转化为 Fe(OH)3 的反应为(用化学方程式表示)。
-
(1) I.绿矾(FeSO4·7H2O)用于治疗缺铁性贫血。课外小组的同学欲测定某补血剂中铁元素的含量。实验步骤如下:
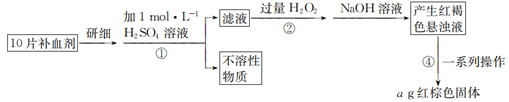
证明步骤①滤液中含有Fe2+的方法是。
-
(2) 步骤②加入过量H2O2的目的是,该步骤中H2O2还可替换为(填字母)。
A.N2 B.O2 C.Cu D.H2
-
(3) 若实验中铁无损耗,则每片补血剂中含铁元素的质量为g。
-
(4) II.高铁酸钠(Na2FeO4)用作新型净水剂等。
Na2FeO4主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5X,则X的化学式为,该反应中氧化剂为。
-
(5) Na2FeO4在水中可以发生如下反应:4FeO
 +10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑。鉴别有胶体产生的方法为。
+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑。鉴别有胶体产生的方法为。
|
离子 |
Cu2+ |
Fe3+ |
Fe2+ |
|
开始沉淀pH |
5.4 |
2.7 |
8.1 |
|
沉淀完全pH |
6.9 |
3.7 |
9.6 |
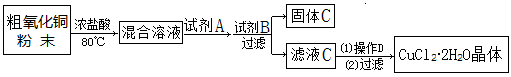
制备流程如下:
-
(1) 加入试剂A是(写化学式),目的是。
-
(2) 加入试剂B是CuO,目的是。
-
(3) 检验滤液C中不含Fe3+的方法是,应控制溶液pH范围为。
-
(4) 固体C的化学式为。
-
(5) 写出操作D的方法。
 ]熔点为306℃,沸点为315℃,易吸水而变质。工业上采用向500~600℃的Fe粉中通入
]熔点为306℃,沸点为315℃,易吸水而变质。工业上采用向500~600℃的Fe粉中通入  来生产无水氯化铁。[
来生产无水氯化铁。[  ]熔点为670℃,易升华。工业上采用向炽热Fe粉中通入HCl来生产无水
]熔点为670℃,易升华。工业上采用向炽热Fe粉中通入HCl来生产无水  。请回答下列问题:
。请回答下列问题: 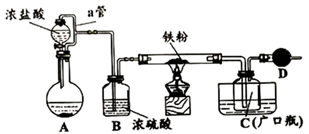
-
(1) 在装置A中装浓盐酸的玻璃仪器名称。
-
(2) D中装的药品是碱石灰,其作用是。
-
(3) 定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。现检验产物中是否含有
 ,可用下列试剂中的(只能选取一种试剂,填序号)进行检验;若含有
,可用下列试剂中的(只能选取一种试剂,填序号)进行检验;若含有  ,预期实验现象为。
,预期实验现象为。 ①
 溶液 ②新制氯水 ③KSCN溶液 ④酸性
溶液 ②新制氯水 ③KSCN溶液 ④酸性  溶液
溶液 -
(4) 定量分析。取装置C中的产物,按下列步骤进行实验:①称取4.60g产品溶于过量的稀盐酸;②加入足量
 溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀至恒重;⑤称量所得红棕色固体为2.40g。回答下列问题:
溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀至恒重;⑤称量所得红棕色固体为2.40g。回答下列问题: ①用离子方程式表示步骤②的目的;
②步骤④灼烧沉淀的化学方程式是。
③该样品中铁元素的质量分数为(结果精确到小数点后两位)。
-
(5) 针对(4)定量分析数据得出的结论,提出改进措施。
①用题目所给的装置制得的产物(不含单质铁)中,铁元素含量(填“相等”、“偏高”或“偏低”),说明含有
 杂质。
杂质。②若要得到较纯净的无水氯化铁,上述“装置”的改进措施是。
【查阅资料】Ⅰ.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
Ⅱ. KSCN中的硫元素为-2价。
Ⅲ.Fe(OH)3受热分解生成Fe2O3。
实验Ⅰ.检验该补铁剂中铁元素的价态。
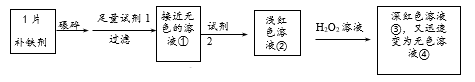
-
(1) 将补铁剂碾碎的目的是。
-
(2) 试剂1是,试剂2是。
-
(3) 加入试剂2后溶液变为浅红色,说明溶液①中含有。
-
(4) 能证明溶液①中含有Fe2+的实验现象是。
-
(5) 补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
H+ + Fe2+ + H2O2 = _+ _
-
(6) 甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
a.甲同学猜测的依据是。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是。
-
(7) 计算每片该补铁剂含铁元素的质量为 g。
-
(8) 人体只能吸收Fe2+ , 医生建议在服用该补铁剂时,同时服用有较强还原性的维生素C,理由是。
 HS-+H2O
C . 用铜电极电解饱和食盐水:2Cl-+2H2O
HS-+H2O
C . 用铜电极电解饱和食盐水:2Cl-+2H2O H2↑+Cl2↑+2OH-
D . 向FeSO4溶液中加入K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
H2↑+Cl2↑+2OH-
D . 向FeSO4溶液中加入K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
 和I-的反应速率,其原理如图所示,依次发生反应1、2,下列说法正确的是( )
和I-的反应速率,其原理如图所示,依次发生反应1、2,下列说法正确的是( )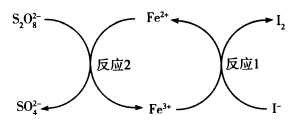
 在负极反应
在负极反应



