实验活动2 铁及其化合物的性质 知识点题库
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
D | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |

①金属钠在纯氧中燃烧
②Fe2(SO4)3溶液中滴入NaOH溶液
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中.
-
(1) I.回答下列有关问题:
①向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是nm。
②电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2 , 制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:。检验反应后溶液中还存在Fe3+的试剂是。
③在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是.
-
(2) II.现有五种溶液,分别含下列离子:①Ag+ , ②Mg2+ , ③Fe2+ , ④Al3+ , ⑤Fe3+。
①写出符合下列条件的离子符号:既能被氧化又能被还原的离子是,加铁粉后溶液增重的是(填写离子符号)
②向Fe2+的溶液中滴加NaOH溶液,现象是 。
③欲除去FeCl2中FeCl3选用的试剂是 , 并写出相应离子方程式:。
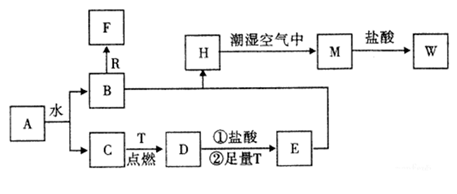
-
(1) 物质A的化学式为 ,F化学式为 ;
-
(2) B和R在溶液中反应生成F的离子方程式为;
-
(3) H在潮湿空气中变成M的实验现象是,化学方程式为;
-
(4) A和水反应生成B和C的化学方程式为,由此反应可知A有作为的用途;
-
(5) W溶液中滴加KSCN溶液出现血红色的离子方程式。
完成下列填空:
-
(1) 钾离子的电子式为。碳原子的电子排布式为;C和N的原子半径大小比较为CN(填“>”、“=”或“<”)。
-
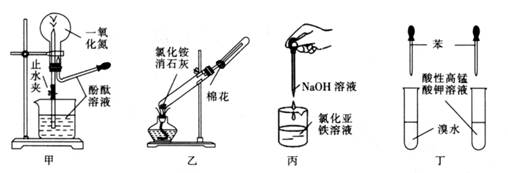
(2) 如图装置所示是KSCN溶于水时的实验现象,该现象说明KSCN溶于水时会(填“吸收”或“放出”)热量,则该溶解过程水合的热效应(填“>”、“=”或“<”)扩散的热效应。

-
(3) KSCN水溶液呈中性,则硫氰酸(HSCN)的电离方程式为;硫氰化铵(NH4SCN)溶液中各种离子浓度由大到小的顺序是。
-
(4) 若用KSCN溶液检验氯化亚铁溶液是否变质,实验方法是。
| 选项 | M | N | P | Q |
| A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
| B | Na | BaCl2 | FeO | KSCN |
| C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
| D | Na2O2 | MgCl2 | Fe | KSCN |
| 选项 | 实验目的 | 实验方案 |
| A | 除去苯中混有的苯酚 | 加入适量的溴水充分反应后过滤 |
| B | 检验Fe2+溶液中是否含有Fe3+ | 向待测液中滴加几滴铁氰化钾溶液 |
| C | 除去粗盐中含有Mg2+、Ca2+、SO42-的试剂加入顺序 | 向该溶液中先加入NaOH溶液、再加BaCl2溶液,最后加碳酸钠溶液 |
| D | 检验SO2中是否含有HCl | 将产生的气体通入HNO3酸化的AgNO3溶液中 |
| 选项 | 实验目的 | 实验方案 |
| A | 配置100 mL 1.0mol/L硫酸铜溶液 | 将25gCuSO4·5 H2O溶于100 mL蒸馏水中 |
| B | 除去碳酸钠固体中混有的碳酸氢钠 | 高温加热 |
| C | 证明Fe2+的氧化性 | 向FeCl2溶液中通入适量Cl2 , 溶液变成棕黄色 |
| D | 证明SO2是电解质或非电解质 | 用电流表测SO2水溶液的导电性 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向一定浓度CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S酸性比H2SO4强 |
| B | 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物X溶液,加热未出现砖红色沉淀 | X不可能是葡萄糖 |
| C | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 反应物浓度越大,反应速率越大 |
| D | 取5mL0.1mol·L-1KI溶液,加入1mL0.1mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
-
(1) 为抑制金属离子水解,可向溶液中加入(填化学式);请写出铝离子水解反应的离子方程式:。
-
(2) Fe2+容易被氧气氧化成,检验久置的FeSO4中含Fe3+的试剂是(填化学式)。
-
(3) 某小组尝试从该混合溶液中分离出铝离子
①先向溶液中加入过量的试剂X,试剂X是(填化学式)。
②经过(填操作名称),取滤液,然后加入过量的试剂Y,试剂Y是(填化学式)。
③该过程主要利用了氢氧化铝的两性。请写出氢氧化铝的电离方程式:。
-
(1) 已知有毒胶囊中含有Fe(CrO2)2 , 其中铬元素是+3价,则其中铁元素的化合价为。
-
(2) 区别明胶水溶液和Na2SO4溶液的方法是。
-
(3) 将饱和FeCl3溶液分别滴入下述液体中,也能形成胶体的是____________。A . 冷水 B . 沸水 C . NaCl溶液 D . NaOH溶液
-
(4) 已知胶体的分散质不能透过半透膜,但小分子或离子能透过半透膜。现将10mL明胶水溶液与5mLNa2SO4溶液混合后装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中。写出能证明Na+透过半透膜的实验方法(具体操作):。
| 选项 | 实验操作 | 实验现象 |
| A | 用湿润的蓝色石蕊试纸检验甲烷与氯气在光照条件下反应后的混合气体 | 石蕊试纸不变色 |
| B | 向酸性高锰酸钾溶液中通入足量的乙烯 | 溶液的紫色逐渐褪去 |
| C | 向AlCl3溶液中滴加过量氨水 | 溶液中先出现白色沉淀后溶解 |
| D | 向FeCl3溶液中滴加KSCN溶液 | 溶液中出现血红色沉淀 |

回答下列问题:
-
(1) D的化学式为。
-
(2) 反应①的一种用途为。
-
(3) 检验E中金属阳离子的实验操作是。
-
(4) 反应③的离子方程式为。
| 选项 | 目的 | 方案设计 | 现象和结论 |
| A | 探究Cu(OH)2和Mg(OH)2溶解度大小 | 向氢氧化钠溶液中先加入少量MgCl2溶液,充分反应后再加入少量CuSO4溶液 | 先产生白色沉淀,后产生蓝色沉淀,则证明Cu(OH)2比Mg(OH)2难溶 |
| B | 检验铁与水蒸气反应中有三价铁 | 取少量铁与水蒸气反应后的固体,先加入稀盐酸再加KSCN溶液 | 若溶液变血红色,则有三价铁,若不变血红色则无三价铁 |
| C | 检验牙膏中是否有甘油 | 取少量该牙膏于试管中,加入适量蒸馏水,搅拌静置后,取上层清液,加入适量新制Cu(OH)2 , 观察现象 | 若产生绛蓝色沉淀,则该牙膏中含有甘油 |
| D | 检验火柴头中的氯元素 | 摘下几根火柴头,将火柴头浸于水中,片刻后取少量溶液于试管中,加硝酸酸化的AgNO3和NaNO2 | 若观察到白色沉淀,则含氯元素 |
-
(1) I.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂等。
向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2+(不考虑空间构型),[Cu(OH)4]2+结构可用示意图表示为。
-
(2) 胆矾CuSO4•5H2O可写为[Cu(H2O)4]SO4•H2O,其结构示意如图:则关于 [Cu(H2O)4]SO4的下列说法中错误的是________
 A . 此配合物中心离子的配位数为4 B . 配体为H2O,配位原子是氧原子 C . 此配合物中Cu2+提供孤对电子 D . 向此配合物溶液中加入BaCl2溶液,将出现白色沉淀
A . 此配合物中心离子的配位数为4 B . 配体为H2O,配位原子是氧原子 C . 此配合物中Cu2+提供孤对电子 D . 向此配合物溶液中加入BaCl2溶液,将出现白色沉淀 -
(3) II.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。
若所得的Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合,所得离子显红色,该离子的离子符号是。
-
(4) 若所得的Fe3+和SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示。
| 选项 | 实验操作和现象 | 结论 |
| A | 将一块镁片与一块铝片经电流表用导线连接,浸入NaOH溶液中,铝片逐渐溶解,电流表指针偏向镁片 | 铝片为负极 |
| B | 将 | |
| C | 将盐酸滴加到 | 非金属性:Cl>S |
| D | 往淀粉溶液中加入少量稀硫酸,加热。待溶液冷却后加入NaOH溶液调至碱性,再加入少量新制 | 淀粉完全水解 |

-
(1) X所含元素的名称为:;固体I的化学式为: 。
-
(2) 检验溶液 G 中的金属阳离子的实验方案: 。
-
(3) 气体 A 与溴水反应的离子方程式: 。
-
(4) X 在高温下与氧气反应的化学方程式: 。
 样品溶于稀硫酸后,滴加KSCN溶液,溶液变红色
样品溶于稀硫酸后,滴加KSCN溶液,溶液变红色 固体中,把产生的气体通入品红溶液,品红溶液褪色
固体中,把产生的气体通入品红溶液,品红溶液褪色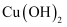 ,继续加热,生成砖红色沉淀
,继续加热,生成砖红色沉淀


