实验活动2 铁及其化合物的性质 知识点题库
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | KSCN可用来检验Fe3+ | 用KSCN溶液检验FeSO4是否变质 |
B | 盐的水解是吸热反应 | 加热可提高盐的水解反应速率 |
C | H2O2有氧化性 | H2O2能使酸性KMnO4溶液褪色 |
D | Al(OH)3是两性氢氧化物 | Al(OH)3可溶于过量浓氨水中 |
绿矾是一种重要的化工原料.
【问题1】绿矾晶体(FeSO4•7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案.可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液请参与完成方案设计.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
方案1:取少量溶液,加入几滴 试剂,如果观察到的现象是 ;实验结论:证明绿矾样品没有被氧化.
方案2:取少量溶液,加入几滴 试剂,如果观察到的现象是 .
实验结论:证明绿矾样品完全被氧化.
使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 .
【问题2】以绿矾为原料可以制取聚合硫酸铁(SPFS).聚合硫酸铁是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.其组成可表示成Fex(OH)y(SO4)z•nH2O(其中Fe为+3价).工业上常用的一种制备流程为:

取7.507g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485g,向上述滤液中加入NH3•H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.800g.通过计算确定该固体聚合硫酸铁样品的化学式为 .(写出计算过程)
晶体硅是一种重要的非金属材料,模拟制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl ![]() SiHCl3+H2 ,
SiHCl3+H2 ,
沸点/℃ | |
SiHCl3 | 33.0 |
SiCl4 | 57.6 |
HCl | ﹣84 |
③SiHCl3与过量H2在1000~1100℃反应制得纯硅可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
-
(1) 粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3 . 该提纯方法为.
-
(2)
用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
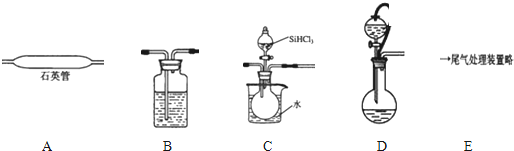
①依次连接的合理顺序为;装置D中g管的作用是;装置B中的试剂是;装置C中的烧瓶加热的目的是.
②装置A中发生反应的化学方程式为.
③操作时应先打开装置(C或D)中分液漏斗的旋塞,理由是:.
-
(3) 请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后.
-
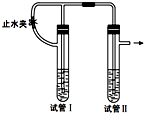
(1) 在试管I中加入的试剂是.
-
(2) 为了制得Fe(OH)2白色沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后观察到试管I产生大量气体.一段时间后,检验到试管Ⅱ支管出口的气体只有一种时,再进行的操作是,使试管I中的溶液进入到试管Ⅱ中溶液底部,产生Fe(OH)2 .
-
(3) 这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是.
-
(4) 反应结束后,将Fe(OH)2沉淀倒出,在空气中迅速变为灰绿色,最后变为红褐色,其原因是(用化学方程式表示).
 观察Fe(OH)2的生成
B .
观察Fe(OH)2的生成
B .  配制一定物质的量浓度的NaNO3溶液
C .
配制一定物质的量浓度的NaNO3溶液
C .  实验室制取氨
D .
实验室制取氨
D .  验证乙烯的生成
验证乙烯的生成

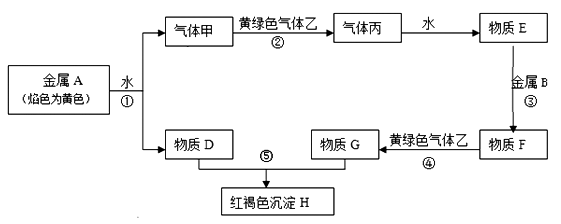
请回答下列问题:
-
(1) 丙的化学式是。
-
(2) 写出下列反应的化学方程式,是离子反应的写离子方程式:
反应①;反应②;反应⑤。
-
(3) 将0.4gD和1.06g
 混合并配成溶液,向溶液中滴加0.1
混合并配成溶液,向溶液中滴加0.1 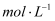 稀盐酸。在下面坐标系中画出能正确表示加入盐酸的体积和生成
稀盐酸。在下面坐标系中画出能正确表示加入盐酸的体积和生成 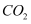 的物质的量的关系图像。
的物质的量的关系图像。 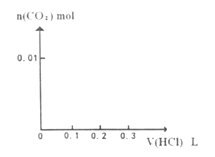
-
(1) Ⅰ.已知A为常见的金属单质,各物质之间有下图所示的关系:

确定A,B,C,D,E,F的化学式:
A为,
B为,
C为,
D为,
E为,
F为。
-
(2) 写出③、④、⑤的离子方程式:
③,
④,
⑤。
-
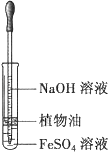
(3) Ⅱ.如图装置,用来制取和观察Fe(OH)2在空气中被氧化的颜 色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:

B中盛有一定量的NaOH溶液,A中应预先加入的试剂是,A中反应的离子方程式。
-
(4) 实验开始时应先将活塞a(填“打开”或“关闭”)。
-
(5) 简述生成Fe(OH)2的操作过程:。
-
(6) 实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为。
-
(1) 在下列反应中,水作氧化剂的是________。A . Cl2+H2O
 HCl+HClO
B . NaH+H2O=NaOH+H2↑
C . 3Fe+4H2O(g)
HCl+HClO
B . NaH+H2O=NaOH+H2↑
C . 3Fe+4H2O(g)  Fe3O4 + 4H2
D . H2+CuO
Fe3O4 + 4H2
D . H2+CuO  H2O+Cu
E . 2NaCl+2H2O
H2O+Cu
E . 2NaCl+2H2O  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
-
(2) 用双桥表示3Cl2+6KOH=5KCl+KClO3+3H2O电子转移的方和数目:。
-
(3) 在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
①若X为Mg,W为C,则Z为。
②若X为SiO2 , W为CO,该反应在工业的用途是。
-
(4) 某未知溶液中可能含有Fe2+ , 确定含该离子的实验方案为:取少量该溶液于试管中,先,再,则说明溶液中含有Fe2+。
-
(1) Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作
反应或现象
结论
取少量除尽Cu2+后的溶液于试管中,加入溶液,振荡
现象
存在Fe3+
取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡
离子方程式
存在Fe2+
-
(2) Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。
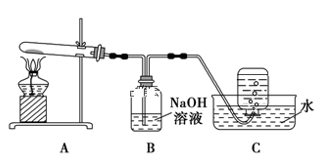

①装置B 的作用是 。
②从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。
③下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2 加热到200℃的化学方程式为 ,继续高温至1000℃生成(填化学式)固体。
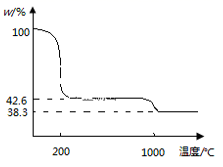 。
。
| 选项 | 实验操作和现象 | 结论 |
| A | 等体积、pH=3的两种酸HA和HB,分别与足量的Zn反应,酸HA放出的氢气多 | 酸性:HB>HA |
| B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品溶于稀硫酸前已氧化变质 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中,气体红棕色加深 | 2NO2(g) |
| D | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | 结合H+的能力: |
| 选项 | 实验目的 | 实验操作 |
| A | 清洗内壁镀银的试管 | 先用稀盐酸洗,再用水清洗 |
| B | 除去FeCl2溶液中少量FeCl3 | 加入过量Cu粉,充分反应后过滤 |
| C | 制取并纯化SO2 | 向Na2SO3固体中加入70%H2SO4溶液,将产生的气体通98%浓硫酸 |
| D | 检验试样中含有Na+ | 用玻璃棒蘸取待测液,在酒精灯火焰上灼烧,火焰呈黄色 |
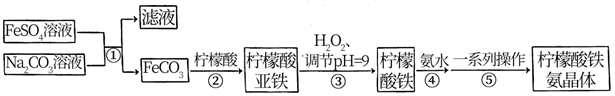 已知:
已知:  、
、  ;柠檬酸亚铁微溶于冷水,易溶于热水。
;柠檬酸亚铁微溶于冷水,易溶于热水。
下列说法正确的是( )
实验l:向FeSO4溶液中滴入少许Na2CO3溶液,出现白色沉淀。
实验2:向FeSO4溶液中加入NaOH溶液,出现白色絮状沉淀,渐变成灰绿色,最后成红褐色沉淀。
实验3:向FeSO4溶液中滴入KSCN溶液,出现红色。
实验4:向FeSO4溶液中滴入酸性KMnO4溶液,KMnO4溶液褪色。
下列说法错误的是( )
 =FeCO3↓
B . 实验2现象说明Fe(OH)2具有还原性
C . 实验3现象说明FeSO4氧化变质
D . 实验4现象说明FeSO4具有漂白性
=FeCO3↓
B . 实验2现象说明Fe(OH)2具有还原性
C . 实验3现象说明FeSO4氧化变质
D . 实验4现象说明FeSO4具有漂白性
 N2O4(g),ΔH<0
N2O4(g),ΔH<0 >C6H5O-
>C6H5O-


