实验活动2 铁及其化合物的性质 知识点题库
①用NaOH溶液和FeSO4溶液制Fe(OH)2时吸有NaOH的滴管;
②制备H2的简易装置中的长颈漏斗;
③分馏石油时控制温度所用的温度计;
④用乙醇制备乙烯时所用的温度计;
⑤用水吸收氨气时的导气管.
-
(1) 上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣=H2O,该反应的化学方程式为.
-
(2) 实验室制备试剂⑦的方法是:.
-
(3) 可用于治疗胃酸过多的试剂是(填序号)
-
(4) 若某溶液中同时存在Fe3+和Fe2+ , 则可用于验证其中含Fe2+的试剂是(填序号);若某溶液中存在Na+、K+、SO42﹣、Cl﹣四种离子,若检验Cl﹣的存在可选用的试剂是(填序号),具体操作方法是.
-
(5) 用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4 , 所需浓H2SO4的体积为 ml(小数点后保留一位有效数字)

-
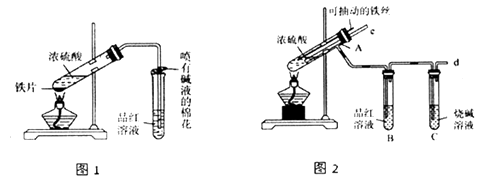
(1) 比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2 , 防止其污染环境;②。
-
(2) 导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻值SO2 气体逸出而防止污染环境;二是。
-
(3) 能说明有SO2气体产生的实验现象是。
-
(4) 反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有 以下三种可能:
I:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A 稀HCl溶液 B 稀硫酸 C KSCN溶液 D KMnO4溶液
E NaOH溶液 F 淀粉KI溶液 G H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号,溶液的颜色变色,则试样中含有Fe3+ , 发生反应的离子方程式为;
步骤2.再取适量的试样,滴加少量的(填试剂序号),溶液颜色的变化为,则试样中含有Fe2+。
 Cu(OH)2+H2↑
Cu(OH)2+H2↑
![]()
试回答下列问题:
-
(1) 试剂1是,试剂2是。
-
(2) 该同学预测加入试剂2后,溶液应依然为浅绿色,但这与实际现象不符,请用离子方程式解释实际现象的合理性:,。
-
(3) 用离子反应方程式解释加入新制氯水后溶液变血红色的原因:。
-
(4) 补铁药物的说明书中通常会有“与VC同服可增加本品吸收”的内容,向淡红色溶液中加入VC , 片刻后溶液红色褪去,试从氧化还原角度解释补铁药物与VC同服的优点:。
【资料】 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色; 溶有溴的 |
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
【提出问题猜想】:
猜想①:溶液呈黄色是因为  被氧化成
被氧化成  所致:
所致:
猜想②:溶液呈黄色是因为  被氧化成
被氧化成  所致。
所致。
-
(1) 【设计实验并验证】
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
试剂
酚酞试液、
 、无水酒精、
、无水酒精、  溶液
溶液方案
操作步骤
实验现象
结论
①
取所述黄色溶液于试管中,滴加并振荡
溶液变红色
猜想①正确
②
取所述黄色溶液于试管中,滴加并振荡
-
(2) 实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了
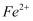 的还原性比
的还原性比  (填“强”或“弱”)。
(填“强”或“弱”)。
-
(3) 【实验反思】
根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入
 并充分振荡后静置,观察到的现象是。
并充分振荡后静置,观察到的现象是。
填写下列空白:
-
(1) B中盛有一定量的NaOH溶液,A中应预先加入的是,A中反应的离子方程式是。
-
(2) 实验开始时应先将活塞a打开,其目的是。
-
(3) 简述生成Fe(OH)2的操作过程:
-
(4) 实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为。
-
(5) 图中(填“能”或“不能”)较长时间看到Fe(OH)2白色沉淀。
-
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。为防止Fe2+被氧化,FeCl2溶液中需加入。
-
(2) 甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的化学反应方程式为。
-
(3) 乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是。
-
(4) 丙组同学取10mL 0.1mol·L-1KI溶液,加入6mL0.1mol·L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号);写出KI与FeCl3反应的离子方程式
-
(1) 现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作是:取一小烧杯,加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
请评价该操作是否正确(填“正确”或“错误”)。
②乙同学的操作是:取一小烧杯,加入40mL饱和FeCl3溶液,用酒精灯加热至沸腾后停止加热。请评价是否正确(填“正确”或“错误”)。
③丙同学的操作是:取一小烧杯,加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,为了使反应进行更加完全,煮沸后继续加热10分钟。
请评价是否正确(填“正确”或“错误”)。
-
(2) 写出制备Fe(OH)3胶体的化学反应方程式:。证明有Fe(OH)3胶体生成的实验操作是,利用的胶体性质是。
-
(3) Fe(OH)3胶体稳定存在的主要原因是___。A . 胶粒直径小于1nm B . 胶粒带正电荷 C . 胶粒作布朗运动 D . 胶粒能透过滤纸
-
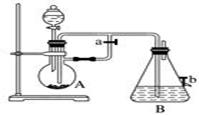
(1) 装碱石灰的仪器是(填仪器名称)。
-
(2) 圆底烧瓶中发生反应的离子方程式。
-
(3) 装置的连接顺序为a→→→→→b→c→f。
-
(4) 反应一段时间后想熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡黄色溶液中加入试剂X,请写出X的化学式。
②固体混合物的成分是(填化学式,已知混合物只有两种物质)
-
(5) 已知红色褪去的同时有气体生成,经检验为O2 , 该小组同学对红色褪去的原因提出了三种假设。
假设Ⅰ:H2O2还原Fe3+ , 使其全部转变为Fe2+;
假设Ⅱ:H2O2分解生成O2 , O2氧化试剂X:
假设Ⅲ:。
并对假设进行了以下实验研究:
①取褪色后溶液并分成三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2 , 无明显变化。
分析并得出结论:实验②说明假设是不正确:实验①②得出假设是正确的。
-
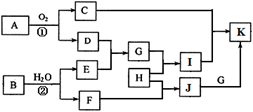
(1) 反应②的化学方程式为,该反应在化工生产中的目的是。
-
(2) 检验I中阳离子的实验操作为。
-
(3) 在化工生产中每燃烧0.12 kg A就会放出853 kJ热量,则A燃烧的热化学方程式为。
 C . 向浸取液中加入KSCN溶液,无明显现象,滴入新制氯水后,溶液变为红色,说明雾霾中Fe2+
D . 向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有
C . 向浸取液中加入KSCN溶液,无明显现象,滴入新制氯水后,溶液变为红色,说明雾霾中Fe2+
D . 向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有 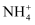
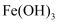 胶体在生活中有重要应用,利用
胶体在生活中有重要应用,利用  和沸水反应制备的
和沸水反应制备的 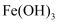 胶体中常混有
胶体中常混有  和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
-
(1) 制取
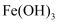 胶体的实验操作是。用的方法除去胶体中的浑浊物;用(填方法或现象)证明胶体已经制成。
胶体的实验操作是。用的方法除去胶体中的浑浊物;用(填方法或现象)证明胶体已经制成。
-
(2)
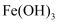 胶体区别于
胶体区别于  溶液的本质特征是。
溶液的本质特征是。
-
(3) 除去胶体中混有的
 和HCl的实验操作名称是。
和HCl的实验操作名称是。
-
(4) 取半透膜外最后一次的溶液少许于试管中,,则证明胶体和
 已经完全分离。
已经完全分离。
 溶液灼烧的变化。将一只白粉笔浸泡在
溶液灼烧的变化。将一只白粉笔浸泡在  溶液中,一段时间后,用坩埚钳夹持粉笔于酒精灯上灼烧,很快观察到粉笔表面颜色的变化:黄色→红褐色→铁锈色。请回答下列问题:
溶液中,一段时间后,用坩埚钳夹持粉笔于酒精灯上灼烧,很快观察到粉笔表面颜色的变化:黄色→红褐色→铁锈色。请回答下列问题: 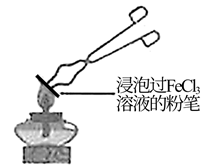
-
(1) 将
 固体溶于水,溶液呈(填“酸”“碱”“中”)性,原因是(用离子方程式解释)。
固体溶于水,溶液呈(填“酸”“碱”“中”)性,原因是(用离子方程式解释)。
-
(2) 配制
 溶液时,先将氯化铁晶体溶于浓盐酸中,再加水稀释到所需要的浓度。该操作的目的是。
溶液时,先将氯化铁晶体溶于浓盐酸中,再加水稀释到所需要的浓度。该操作的目的是。
-
(3) 甲同学将“铁锈色”物质高温灼烧,“铁锈色”变成了“黑色”。他认为“黑色”物质可能是酒精灼烧粉笔的产物。乙同学想要通过实验来证明甲同学是错的,他进行的实验操作和现象是。
-
(4) 乙同学发现“黑色”物质完全被磁铁吸引,推测“黑色”物质是(填化学式),写出“铁锈色→黑色”反应的化学反应方程式。
①合金的硬度一般比它的成分金属的硬度都大
②合金的熔点一般比它的成分金属的熔点都低
③改变原料的配比、变更制造合金的工艺,可得到不同性能的合金
④氢氧化亚铁在空气中加热可以得到氧化亚铁
⑤在制备氢氧化亚铁时需要将胶头滴管插入到液面以下
⑥合金的应用范围比纯金属更广
选项 | 实验内容 | 实验结论 |
A | 将Fe(NO3)2样品溶于H2SO4后,加入KSCN,溶液显红色 | Fe(NO3)2已经氧化变质 |
B | 取1 mL0.1 mol/L KI溶液于试管中,加入5 mL0.1 mol/LFeCl3 , 充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI和FeCl3反应有一定限度 |
C | 向2支盛有5 mL不同浓度NaHSO3溶液的试管中,同时加入2 mL 5% H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
D | 用pH试纸测定NaCl和NaF溶液的pH,pH(NaCl)<pH(NaF) | 结合H+能力:Cl-<F- |
 B . 取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,置于火焰上灼烧,火焰呈黄色,则溶液中一定含有氯化钠
C . 取适量待测液于试管中,滴入足量KSCN溶液,无明显现象,再滴入适量氯水,溶液变为血红色,则原待测液中一定含有Fe3+
D . 于试管中加热某固体纯净物样品,试管口出现小水珠,则该样品中一定存在结晶水
B . 取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,置于火焰上灼烧,火焰呈黄色,则溶液中一定含有氯化钠
C . 取适量待测液于试管中,滴入足量KSCN溶液,无明显现象,再滴入适量氯水,溶液变为血红色,则原待测液中一定含有Fe3+
D . 于试管中加热某固体纯净物样品,试管口出现小水珠,则该样品中一定存在结晶水



