第一节 原子结构与元素周期表 知识点题库
X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下列说法中正确的是
A . 第一电离能X<Y
B . X的原子半径比Y小
C . 电负性X>Y
D . X和Y的核电荷数之差为m-n
下列判断中一定正确的是 ( )
A . 若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强
B . 若R2-和M+的电子层结构相同,则原子序数:R>M
C . 若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
D . 若M,N是同主族元素,且原子序数:M>N,则非金属性:M>N
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
-
(1) 下列叙述正确的是 . (填字母)A . CH2O与水分子间能形成氢键 B . CH2O和CO2分子中的中心原子均采用sp2杂化 C . C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 D . CO2晶体的熔点、沸点都比二氧化硅晶体的低
-
(2) Mn和Fe的部分电离能数据如表:
元素
Mn
Fe
电离能
/kJ•mol﹣1
I1
717
759
I2
1509
1561
I3
3248
2957
Mn元素价电子排布式为,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是.
-
(3)
Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为.

-
(4) 电镀厂排放的废水中常含有剧毒的CN﹣离子,可在X的催化下,先用NaClO将CN﹣氧化成CNO﹣ , 再在酸性条件下CNO﹣继续被NaClO氧化成N2和CO2 .
①与CNO﹣互为等电子体微粒的化学式为(写出一种即可).
②氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式.
根据题目要求填空:
-
(1) Mg2+的结构示意图为;O的电子式为;H2S的结构式为.
-
(2) 氯化钠的电子式为,溶于水发生电离的电离方程式为,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为.
下列叙述中,肯定能说明金属甲比金属乙金属性强的是( )
A . 甲原子最外层电子数比乙原子最外层电子数少
B . 甲原子电子层数比乙原子电子层数多
C . 1mol甲从酸中置换生成的氢气比1mol乙从酸中置换生成的氢气多
D . 常温下,甲能与水反应生成氢气,而乙不能
已知aAn+、bB(n+1)+、cCn﹣、dD(n+1)﹣具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A . 气态氢化物的稳定性:D>C
B . 原子序数:b>a>c>d
C . 最高价氧化物对应水化物的碱性:B>A
D . 四种元素一定属于短周期元素
Se、Br两种元素的部分信息如如图所示,下列说法正确的是( )
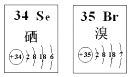
A . 原子半径:Br>Se
B . 还原性:Se2﹣<Br﹣
C . 在Se2Br2分子中只含有极性键
D . SeO2 既有氧化性又有还原性
已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )
A . 原子半径:Sr>Ca
B . 最高化合价为+2
C . 8838Sr的中子数为38
D . 氢氧化物为强碱
W、X、Y、Z均为的短周期元素,原子序数依次增加,W的原子核外最外层电子数是次外层的2倍,X-、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法正确的是( )
A . 原子半径:Y>Z>X>W
B . 简单氢化物的熔沸点:Z>X>W
C . X与Y两种元素组成的化合物是离子化合物
D . 最高价氧化物的水化物的酸性:W <Z<X
短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )
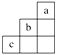
A . a是一种活泼的非金属元素
B . c的最高价氧化物的水化物是一种弱酸
C . b的氢化物很稳定
D . b元素的最高化合价为+7价
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A . Cl-的结构示意图 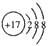 B . 铁红的化学式为Fe3O4
C . 甲醛的结构简式:CH2O
D . CO2的电子式
B . 铁红的化学式为Fe3O4
C . 甲醛的结构简式:CH2O
D . CO2的电子式 
-
(1) 写出氯原子的原子结构示意图,NH4Cl的电子式;
-
(2) 用电子式表示H2O的形成过程;
-
(3) 已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量(填“高”、“低”),故白磷比红磷稳定性(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,放出热量多。
-
(4) 在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
-
(5) 电解法冶炼金属铝的化学方程式为。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为,引发铝热反应的实验操作是。
质量为 25.6 g的 KOH和KHCO3的混合物,先在 250℃煅烧,冷却后发现混合物的质量损失4.9g,则原混合物中KOH和KHCO3的物质的量的关系为( )
A . KOH物质的量>KHCO3物质的量
B . KOH物质的量<KHCO3物质的量
C . KOH物质的量=KHCO3物质的量
D . KOH和KHCO3以任意比混合
用碳化铝制取甲烷的化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑。下列有关化学用语表示正确的是( )
A . 铝离子的电子排布式:1s22s22p63s23p1
B . 水分子的结构式:H—O—H
C . 甲烷的比例模型:  D . 氢氧化铝的电离方程式:H++AlO2-+H2O=Al(OH)3=Al3++3OH-
D . 氢氧化铝的电离方程式:H++AlO2-+H2O=Al(OH)3=Al3++3OH-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y的一种核素在考古时用于测定一些文物的年代,Z原子最外层电子数是次外层电子数的3倍,R与Z处于同一主族, W是短周期中金属性最强的金属元素。下列说法正确的是( )
A . 简单氢化物的沸点Y>Z
B . Y2X2分子中σ键和π键的数目之比为3︰2
C . 简单离子半径R>W>Z
D . 元素Z、W形成的化合物中只含离子键
短周期主族元素A、B、C、D、E的原子序数依次增大,其原子半径和原子最外层电子数之间的关系如图所示。回答下列问题:

-
(1) B在元素周期表中的位置为;A、B组成的原子个数比为1:1的化合物的电子式为。
-
(2) B、C的简单离子中半径较大的是(填离子符号)A、B、C三种元素组成的化合物中含有的化学键类型是。
-
(3) C、E的最高价氧化物对应的水化物反应的离子方程式为。
-
(4) 下列叙述能说明E的非金属性强于D的是(填序号)。
a.E的简单氢化物的稳定性比D的强
b.D的氧化物对应的水化物的酸性比E的弱
c.D的单质常温下为固体,E的单质常温下为气体
d.将E的单质通入D的简单氢化物的水溶液中,有D的单质生成
金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
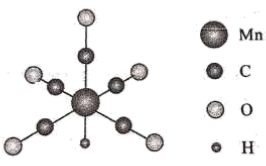
回答问题:
-
(1) 基态锰原子的价层电子排布式为。
-
(2) 配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为。
-
(3) 第一电离能的大小:CO(填“大于”或“小于”)。
-
(4)
 中碳原子的杂化轨道类型是,写出一种与具有相同空间结构的-1价无机酸根离子的化学式。
中碳原子的杂化轨道类型是,写出一种与具有相同空间结构的-1价无机酸根离子的化学式。
-
(5) CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为。
-
(6) MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是。
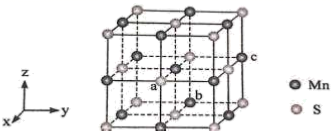
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为
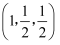 ,b点锰原子坐标为
,b点锰原子坐标为 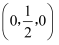 ,则c点锰原子坐标为。
,则c点锰原子坐标为。
已知某氧原子的符号所示:  ,其核电荷数是( )
,其核电荷数是( )
 ,其核电荷数是( )
,其核电荷数是( )
A . 8
B . 10
C . 18
D . 26
含铜物质在生产生活中有着广泛应用回答下列问题:
-
(1) 基态Cu原子最高能层的电子排布式为。
-
(2) CuCl2稀溶液中存[Cu(H2O)6]2+。已知d轨道也可以参与杂化,则[Cu(H2O)6]2+中Cu的杂化方式为____(填选项字母)。A . sp3 B . sp3d C . sp3d2 D . dsp2
-
(3) 铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺形成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。
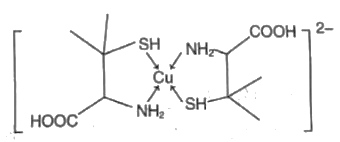
①比较硫化氢与氨气键角的大小:H2SNH3(填“>”或“<”) 。
②第二周期元素中,第一电离能大于N的元素有(用元素符号表示)。
③请解释该化合物易溶于水的主要原因:。
④该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有个。
-
(4) Cu+与CN-形成长链阴离子,其结构片段如图所示,该阴离子中σ键与π键数目之比为。
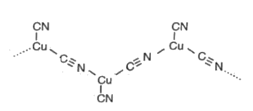
-
(5) 一种由Cu、In、Te组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
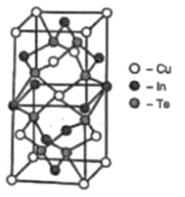
①In的配位数为;晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为。
②若晶胞底边正方形的边长均为anm,高为cnm,阿伏加德罗常数的值为NA设晶体的最简式的式量为Mr,则该晶体的密度为g·cm-3(列出计算式)。
盐在生产、生活中有广泛应用。下列盐的性质与用途具有对应关系的是( )
A . NaClO有强氧化性,可用于消毒杀菌
B . NaHSO3有还原性,可用于漂白纸浆
C . NaCl易溶于水,可用于工业电解制备钠
D . NaHCO3受热易分解,可用于制抗酸药物
最近更新



