第二单元 物质的化学计量 知识点题库
下列对于“摩尔”的理解正确的是( )
A . 摩尔是国际科学界建议采用的一种物理量
B . 摩尔是物质的量的单位,简称摩,符号为mol
C . 摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D . 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
下列叙述正确的是( )
A . 1molH2O的质量为18g/mol
B . 标准状况下,1mol任何物质体积均为22.4L
C . CH4的摩尔质量为16g
D . 3.01×1023个SO2分子的质量为32g
某氯原子的质量是ag,12C原子的质量是b g,用NA表示阿伏加德罗常数的值.下列说法正确的是( )
A . 该氯原子的相对原子质量为 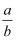 B . m g该氯原子的物质的量为
B . m g该氯原子的物质的量为  mol
C . 该氯原子的摩尔质量为aNAg
D . a g该氯原子所含的电子数为17 mol
mol
C . 该氯原子的摩尔质量为aNAg
D . a g该氯原子所含的电子数为17 mol
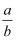 B . m g该氯原子的物质的量为
B . m g该氯原子的物质的量为  mol
C . 该氯原子的摩尔质量为aNAg
D . a g该氯原子所含的电子数为17 mol
mol
C . 该氯原子的摩尔质量为aNAg
D . a g该氯原子所含的电子数为17 mol
若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A . 1mol Cl2作为氧化剂得到的电子数为NA
B . 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C . 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D . NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4
15g A和10.5g B完全反应,生成7.2g C、1.8g D和0.3mol E,则E的摩尔质量为( )(提示:用质量守恒观点解答)
A . 100 g•mol﹣1
B . 27.5 g•mol﹣1
C . 55 g•mol﹣1
D . 16.5 g•mol﹣1
NA为阿伏加德罗常数的值.下列说法正确的是( )
A . 1 mol FeCl3水解生成的 Fe(OH)3胶粒数为 1NA
B . 将 1mol Cl2通入水中,HClO、Cl、ClO 粒子数之和为 2NA
C . 1 mol Fe 溶于过量硝酸,电子转移数为 2NA
D . 10℃时,1L pH=1.0 的 H2SO4溶液中含 H+为 0.1NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 标准状况下,22.4L苯所含的碳碳双键数为3NA
B . 常温常压下,28 g乙烯和丙烯(C3H6)的混合气体中所含氢原子数为4NA
C . 1 mol金属钠在足量乙醇完全反应转移的电子数为2NA
D . 1 mol·L-1的醋酸溶液中含醋酸分子数为NA
设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A . 在标准状况下,2.24LSO3中含氧原子数为0.3NA
B . 1L0.1mol/L(NH4)2Fe(SO4)2溶液中,阳离子总数为0.3NA
C . 常温常压下,4.2g乙烯和环丙烷的混合气体中所含原子总数为0.9NA
D . 将0.1molCl2通入足量热的浓NaOH溶液中完全反应生成NaCl、NaClO3和水,转移电子数为0.1NA
已知32gX和40gY恰好完全反应,生成mgQ和9gH,在相同条件下,16gX和30gY混合反应生成0.25molQ及若干摩尔H,则物质Q的摩尔质量应是( )
A . 163 g/mol
B . 126 g/mol
C . 122 g/mol
D . 63 g/mol
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A . 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
B . 1mol FeCl3形成的 Fe(OH)3胶体中,胶体颗粒的数目为NA
C . 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA
D . 18g重水(D2O)所含的电子数为10NA
如果1g水中含有n个氢原子,则阿伏加德罗常数是( )
A .  mol-1
B . 9n mol-1
C . 2n mol-1
D . n mol-1
mol-1
B . 9n mol-1
C . 2n mol-1
D . n mol-1
 mol-1
B . 9n mol-1
C . 2n mol-1
D . n mol-1
mol-1
B . 9n mol-1
C . 2n mol-1
D . n mol-1
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A . 常温常压下28g氮气所含有的分子数目为NA
B . 标准状况下,22.4L水中含有NA个水分子
C . 2.3g金属钠变为钠离子时失去的电子数为0.2NA
D . 1mol•L﹣1KCl溶液中含有Cl﹣的个数为NA
阴离子Xn-含中子N个,X的质量数为A,则agX的氢化物中含质子的物质的量是( )
A . 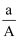 (N-a)mol
B .
(N-a)mol
B .  (n+A)mol
C .
(n+A)mol
C .  (N+n)mol
D .
(N+n)mol
D .  (A-N+n)mol
(A-N+n)mol
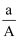 (N-a)mol
B .
(N-a)mol
B .  (n+A)mol
C .
(n+A)mol
C .  (N+n)mol
D .
(N+n)mol
D .  (A-N+n)mol
(A-N+n)mol
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 15g甲基(-CH3)所含有的电子数是10NA
B . 标准状况下,2.24L的水所含的分子数为0.1NA
C . 28g乙烯和丙烯的混合物中总共含有的原子数目为6NA
D . 16g甲烷与足量氯气在光照下充分反应后产物中含有的CCl4分子数为NA
下列说法中,正确的是( )
A . 1 mol CO2中含有的原子数为 NA
B . 1 mol N2 与 1 mol O2 的质量比为 7:8
C . 常温常压下,1 mol CO 的体积是 22.4 L
D . 0.1 mol·L-1 Na2SO4溶液中含有 0.2 mol Na+
镓(Ga)位于周期表中第四周期第IIIA族,与强酸、强碱溶液均能反应生成H2 , 是一种应用广泛的金属元素,可用于制造半导体材料氮化镓、砷化镓、磷化镓等。同温同压下,  分别与
分别与 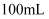 浓度均为
浓度均为  的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为
的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为  和
和  。下列说法错误的是( )
。下列说法错误的是( )
 分别与
分别与 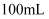 浓度均为
浓度均为  的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为
的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为  和
和  。下列说法错误的是( )
。下列说法错误的是( )
A .  B . 转移的电子数之比为
B . 转移的电子数之比为  C . 消耗酸和碱的物质的量之比为
C . 消耗酸和碱的物质的量之比为  D . 反应前后两溶液的质量变化相等
D . 反应前后两溶液的质量变化相等
 B . 转移的电子数之比为
B . 转移的电子数之比为  C . 消耗酸和碱的物质的量之比为
C . 消耗酸和碱的物质的量之比为  D . 反应前后两溶液的质量变化相等
D . 反应前后两溶液的质量变化相等
NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A .  金刚石中含有化学键数目为4NA
B . 标准状况下
金刚石中含有化学键数目为4NA
B . 标准状况下 通过足量
通过足量 充分反应,转移电子数目为NA
C . 用惰性电极电解饱和食盐水,转移电子数为NA时,生成的
充分反应,转移电子数目为NA
C . 用惰性电极电解饱和食盐水,转移电子数为NA时,生成的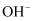 浓度为
浓度为 D . 一定温度下,
D . 一定温度下, 溶液与
溶液与 溶液中
溶液中 的数目均小于0.5NA , 且前者更少
的数目均小于0.5NA , 且前者更少
 金刚石中含有化学键数目为4NA
B . 标准状况下
金刚石中含有化学键数目为4NA
B . 标准状况下 通过足量
通过足量 充分反应,转移电子数目为NA
C . 用惰性电极电解饱和食盐水,转移电子数为NA时,生成的
充分反应,转移电子数目为NA
C . 用惰性电极电解饱和食盐水,转移电子数为NA时,生成的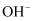 浓度为
浓度为 D . 一定温度下,
D . 一定温度下, 溶液与
溶液与 溶液中
溶液中 的数目均小于0.5NA , 且前者更少
的数目均小于0.5NA , 且前者更少
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 标准状况下,2.24 L的CHCl3含有C-Cl键的数目为0.3 NA
B . 1 L pH=1的盐酸中含有阴离子总数为0.1NA
C . 1 mol NH4F固体中含有的共价键数目为5 NA
D . 常温下,18 g水中含有的OH- 数目为10-7 NA
A、B、C、D为前三周期的四种元素,化合物X(X的摩尔质量为594g·mol-1)由四种元素组成。A、B的价层电子排布可表示为asa , bsbbp2b , B、C同主族,化合物Z是最常见的溶剂,混合气体W能使晶红溶液褪色,气体G能使带火星的木条复燃。各物质间有如图转化关系,某兴趣小组展开如图实验(气体的体积均在标准状况下测得):

请回答:
-
(1) 化合物X的组成元素是。
-
(2) 白色沉淀H的化学式,写出H的一种用途。
-
(3) 写出X高温分解的化学方程式为。
-
(4) 溶液E与NaOH溶液发生非氧化还原反应可制得X,化学方程式为。
-
(5) 关于混合气体W能使品红溶液褪色的原因,一般认为:W混合气体能使品红褪色,不是其中某种气体本身与品红作用,而是该气体与水反应的生成物使品红褪色。请设计实验证明。
有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol/L Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是( )
A . 原混合物中CuO与Fe2O3的质量之比为2:1
B . 原混合物中CuO与Fe2O3物质的量之比为3:1
C . 反应中生成的CO2体积为1.792 L
D . 吸收CO2后溶液中一定有Ba(HCO3)2
最近更新



