第二单元 物质的化学计量 知识点题库
下列说法中正确的是( )
A . 摩尔既是物质的数量单位又是物质的质量单位
B . 物质的量是国际单位制中七个基本单位之一
C . 阿伏加德罗常数是0.012kg 12C中含有的碳原子数目
D . 标准状况下,1molH2O所占的体积为22.4L
填空
-
(1) 氮原子的摩尔质量是,1mol HNO3的质量是,1mol HNO3约含有个氧原子.
-
(2) 标准状况下11.2L HCl的物质的量是.将这些气体溶于水中配成1L溶液,所得盐酸的物质的量浓度是.
-
(3) 2mol OH﹣含有的电子数为.
下列说法中,正确的是( )
A . 标准状况下,22.4 L水中含有6.02×1023个水分子
B . 32 g氧气所含的原子数目为2×6.02×1023
C . 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L
D . 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl﹣的物质的量浓度为1 mol/L
设NA为阿伏加德罗常数,下列说法不正确的是( )
A . 2.0g重水(D2O)中含有的中子数为NA
B . 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA
C . 23g金属钠变为钠离子时失去的电子数为NA
D . 常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA
设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
A . 22.4 L CO2与CO的混合气体中含碳原子数为NA
B . 常温下,1L 0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2 NA
C . 在反应KIO3 + 6HI=KI + 3I2 + 3H2O中,每生成3 mol I2转移的电子数为6 NA
D . 在铁参与的反应中,5.6 g铁完全反应失去的电子数一定为0.3 NA
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A . 1.5 gCH3+含有的电子数为NA
B . 在1 L 0.1mol/L氯化铝溶液中阳离子总数大于0.1NA
C . 60g SiO2和12g金刚石中各含有4NA个Si—O键和4NA个C—C键
D . 标准状况下,11.2 L四氯化碳中含有的C—Cl键的个数为2NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 将1mol SO2通入水中,H2SO3、HSO3-、SO32-粒子数之和为NA
B . 标准状况下,22.4L HF溶于水,溶液中HF与F-数目之和为1NA
C . 将1mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D . 25℃时,pH=13的Ba(OH)2溶液中含有的氢氧根离子数为0.1NA
同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是( )
A . 质子数之比为1∶1
B . 密度比为11∶8
C . 物质的量之比为8∶11
D . 原子个数比1∶1
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 0.1 mol C3H6分子中含有的碳碳双键数为0.1NA
B . 常温下,1LpH=2的CH3COOH溶液中含有的CH3COO-数为0.01NA
C . 25.6g铜与一定量的浓硝酸完全反应时,转移的电子数为0.8NA
D . 标准状况下,2.24LS16O2和S18O3的混合物中含有的硫原子数为0.1NA
NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
B . 含NA个Na+的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1mol·L-1
C . 在  反应中,每生成32g氧气,则转移2NA个电子
D . 常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含
反应中,每生成32g氧气,则转移2NA个电子
D . 常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含  物质的量相同
物质的量相同
 反应中,每生成32g氧气,则转移2NA个电子
D . 常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含
反应中,每生成32g氧气,则转移2NA个电子
D . 常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含  物质的量相同
物质的量相同
-
(1) 1molCO2中含有molC和molO;
-
(2) 1.80molCO2中含有个CO2分子,个C原子,个O原子;
-
(3) 3.60molCO2中所含CO2分子数与个H2O分子数目相等,8.40×1026个O3分子的物质的量是。
下列说法中,错误的是( )
A . “物质的量”表示含有一定数目粒子的集合体,是七个基本物理量之一
B . “摩尔”是物质的量的单位
C . 1 mol任何物质都约含6.02×1023个原子
D . 一个水分子的质量约为  ×10-23 g
×10-23 g
 ×10-23 g
×10-23 g
设  为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A .  溶液中含有
溶液中含有  数目为
数目为  B . 含
B . 含  的浓盐酸与足量
的浓盐酸与足量  反应,转移电子数目为
反应,转移电子数目为  C . 标准状况下,
C . 标准状况下,  己烷在
己烷在  中完全燃烧,产生
中完全燃烧,产生  分子数目为
分子数目为  D . 常温下,
D . 常温下,  与
与  的混合气体中所含的原子数目为
的混合气体中所含的原子数目为 
 溶液中含有
溶液中含有  数目为
数目为  B . 含
B . 含  的浓盐酸与足量
的浓盐酸与足量  反应,转移电子数目为
反应,转移电子数目为  C . 标准状况下,
C . 标准状况下,  己烷在
己烷在  中完全燃烧,产生
中完全燃烧,产生  分子数目为
分子数目为  D . 常温下,
D . 常温下,  与
与  的混合气体中所含的原子数目为
的混合气体中所含的原子数目为 
将24.5gKClO3固体与8.7gMnO2固体混合加热片刻,得到标况下VL气体,冷却后固体质量为25.52g;再将剩余固体溶于水并加入足量亚硝酸钠和硝酸银溶液,再加足量的稀硝酸,过滤、洗涤、干燥得到m克固体。求:
-
(1) 标准状况下气体体积V为。
-
(2) 最后所得固体质量m为g。
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 1 mol Na2O2固体中离子总数为4NA
B . 标准状况下,22.4 L水中所含分子数为NA
C . 常温常压下,16 g氧气中所含原子数为NA
D . 等物质的量的N2和CO所含有原子数均为2NA
某Fe2(SO4)3溶液VmL中含有SO  ag,现从中取出该溶液体积的
ag,现从中取出该溶液体积的 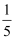 ,稀释成5VmL,稀释后的溶液中Fe3+的物质的量浓度为( )
,稀释成5VmL,稀释后的溶液中Fe3+的物质的量浓度为( )
 ag,现从中取出该溶液体积的
ag,现从中取出该溶液体积的 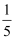 ,稀释成5VmL,稀释后的溶液中Fe3+的物质的量浓度为( )
,稀释成5VmL,稀释后的溶液中Fe3+的物质的量浓度为( )
A .  mol•L-1
B .
mol•L-1
B .  mol•L-1
C .
mol•L-1
C .  mol•L-1
D .
mol•L-1
D .  mol•L-1
mol•L-1
 mol•L-1
B .
mol•L-1
B .  mol•L-1
C .
mol•L-1
C .  mol•L-1
D .
mol•L-1
D .  mol•L-1
mol•L-1
电解法测定铜的相对原子质量的装置如图所示,调节电阻使电流稳定在  ,通电电解
,通电电解 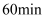 。取下铜片,水洗、醇洗后晾干,精确称量如下:
。取下铜片,水洗、醇洗后晾干,精确称量如下:
 ,通电电解
,通电电解 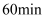 。取下铜片,水洗、醇洗后晾干,精确称量如下:
。取下铜片,水洗、醇洗后晾干,精确称量如下: 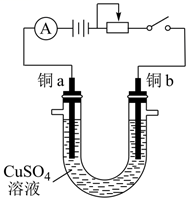
电解前:铜a与铜b的质量分别 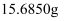 和
和  :
:
电解后:铜a与铜b的质量分别  和
和  。
。
已知:  电子的电量为
电子的电量为 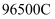 ,电路中通过的总电量
,电路中通过的总电量  (t单位为秒)。
(t单位为秒)。
则测得的铜元素的相对原子质量为(计算结果保留3位有效数字),写出简要计算过程。
已知稀的硝酸与金属Al的反应为8Al+30HNO3=3NH4NO3+8Al(NO3)3+9H2O,用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 0.5mol·L-1的NH4NO3溶液中所含NO 的数目为0.5NA
B . 标准状况下,22.4LH2O中质子的数目为10NA
C . 该反应中,每消耗9g金属铝,转移的电子数为NA
D . 1molAl3+和18gNH
的数目为0.5NA
B . 标准状况下,22.4LH2O中质子的数目为10NA
C . 该反应中,每消耗9g金属铝,转移的电子数为NA
D . 1molAl3+和18gNH 中所含的质子数与中子数均为10NA
中所含的质子数与中子数均为10NA
 的数目为0.5NA
B . 标准状况下,22.4LH2O中质子的数目为10NA
C . 该反应中,每消耗9g金属铝,转移的电子数为NA
D . 1molAl3+和18gNH
的数目为0.5NA
B . 标准状况下,22.4LH2O中质子的数目为10NA
C . 该反应中,每消耗9g金属铝,转移的电子数为NA
D . 1molAl3+和18gNH 中所含的质子数与中子数均为10NA
中所含的质子数与中子数均为10NA
设NA为阿伏加德罗常数的值。下列说法中正确的是( )
A . 1 mol Na2SO4溶于水中,所得溶液中Na+个数为NA
B . 22.4 L氢气含有氢原子个数为2NA
C . NA个氢气分子和NA个氧气分子的质量比为1︰16
D . 18 g水含有原子数为3NA , 所含的电子数为8NA
某人的体检报告中显示,其血液中葡萄糖含量为 , 则其
, 则其 血液中含葡萄糖分子的数目约为( )
血液中含葡萄糖分子的数目约为( )
 , 则其
, 则其 血液中含葡萄糖分子的数目约为( )
血液中含葡萄糖分子的数目约为( )
A . 5
B .  C .
C .  D .
D . 
 C .
C .  D .
D . 
最近更新



