第二单元 物质的化学计量 知识点题库
下列叙述正确的是( )
A . 1 mol H2O的质量为18g/mol
B . 标准状况下,1 mol任何物质体积均为22.4L
C . CH4的摩尔质量为16g
D . 3.01×1023个SO2分子的质量为32g
标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,求:
-
(1) 所得盐酸的物质的量浓度为;
-
(2) 若将此溶液再稀释成1L溶液,则稀释后盐酸的物质的量浓度变为;
-
(3) 将(2)的溶液取出250mL与足量Zn反应可以产生的H2在标准状况下的体积为.
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于;此比例的H2和O2混合气体的平均摩尔质量为.

下列叙述中正确的是( )
A . 物质的量就是物质的质量
B . 物质的量就是物质的数量
C . 物质的量就是摩尔
D . 物质的量的单位是摩尔
在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2 , 100mL;b.O2 , 200mL;c.N2 , 400mL;d.CH4 , 600mL,则4个容器中气体的质量由大到小的顺序是( )
A . a>b>c>d
B . b>a>d>c
C . c>d>b>a
D . d>c>a>b
已知ag气体X2中含有b个X原子,那么cg该气体在0℃、1.01×105 Pa条件下的体积是(NA 表示阿伏加德罗常数的值)( )
A .  L
B .
L
B .  L
C .
L
C .  L
D .
L
D .  L
L
 L
B .
L
B .  L
C .
L
C .  L
D .
L
D .  L
L
下列物质各1 mol,质量最大的是( )
A . H2
B . O2
C . H2O
D . CO2
将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A . 1︰3
B . 3︰2
C . 1︰1
D . 2︰3
两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的 (C-12 N-14 O-16)( )
①原子总数 ②氧原子总数 ③分子总数 ④质量
A . ①②
B . ②③
C . ①③
D . ②④
在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的( )
A . 原子数
B . 分子数
C . 质量
D . 电子数
下列叙述正确的是( )
A . 同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等
B . 一定温度、压强下,气体体积由其物质的量的多少决定
C . 气体摩尔体积是指1 mol 任何气体所占的体积为22.4 L
D . 不同的气体,若体积不等,则它们所含的分子数一定不等
设NA 表示阿伏加德罗常数的值,下列说法正确的是( )
A . 100 mL 0.1 mol·L-1的稀硫酸中含有SO42-个数为0.1NA
B . 含1 mol HCl的盐酸与足量Fe反应,Fe所失去的电子总数为2 NA
C . 4℃ 时,5.4 mL水中所含的水分子数是0.3 NA
D . 标准状况下,22.4L氢气所含的质子数为NA
-
(1) 有以下四种物质:①22g二氧化碳②8g氢气③1.204×1024个氮气分子④4℃时18mL水它们所含分子数最多的是,所含原子数最多的,质量最大的是所含电子数最多的是(填序号)
-
(2) 12.4 gNa2R含Na+0.4mol,则Na2R的摩尔质量为,R的相对原子质量为,含R的质量为1.6g的Na2R,其物质的量为。
下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.2molPH3
②标准状况下22.4LNe
③4℃下9mL水
④含有1.806×1023个氧原子的SO3
A . ①④②③
B . ③②①④
C . ②③①④
D . ①④③②
将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0
mL。试计算:
-
(1) 原均匀混合物中NaHCO3的物质的量n(NaHCO3)= mol;
-
(2) 盐酸的浓度c(HCl)= mol·L-1。
将4.0 g NaOH和5.3 g Na2CO3混合并配成溶液,向溶液中逐滴缓慢滴加0.5 mol/L稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的体积(标况下)的关系的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A . 标准状况下,22.4L二氯甲烷中含有4NA极性共价键
B . 向1L0.5mol/L盐酸溶液中通入NH3至中性(忽略溶液体积变化),此时NH  个数为0.5NA
C . 加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数为0.2NA
D . 0.1mol环氧乙烷(
个数为0.5NA
C . 加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数为0.2NA
D . 0.1mol环氧乙烷(  )中含有的共价键数为0.3NA
)中含有的共价键数为0.3NA
 个数为0.5NA
C . 加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数为0.2NA
D . 0.1mol环氧乙烷(
个数为0.5NA
C . 加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数为0.2NA
D . 0.1mol环氧乙烷(
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 1.7g﹣OH中含有的电子数为NA
B . 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6NA
C . 标准状况下,11.2L二氯甲烷所含分子数为0.5NA
D . 42g乙烯与丙烯的混合气体中含碳原子数为3NA
实验室中制取  时,将13 g锌铁合金完全溶于100 mL
时,将13 g锌铁合金完全溶于100 mL 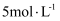 盐酸中。假设反应前后溶液的体积不发生变化,下列说法错误的是( )
盐酸中。假设反应前后溶液的体积不发生变化,下列说法错误的是( )
 时,将13 g锌铁合金完全溶于100 mL
时,将13 g锌铁合金完全溶于100 mL 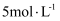 盐酸中。假设反应前后溶液的体积不发生变化,下列说法错误的是( )
盐酸中。假设反应前后溶液的体积不发生变化,下列说法错误的是( )
A . 反应生成的气体在标准状况下的体积大于4.48L
B . 最终所得溶液中  浓度为
浓度为 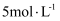 C . 可用碱石灰除去
C . 可用碱石灰除去  中混有的
中混有的  和水蒸气
D . 向所得溶液中加入过量
和水蒸气
D . 向所得溶液中加入过量  溶液最终会观察到有红褐色沉淀生成
溶液最终会观察到有红褐色沉淀生成
 浓度为
浓度为 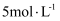 C . 可用碱石灰除去
C . 可用碱石灰除去  中混有的
中混有的  和水蒸气
D . 向所得溶液中加入过量
和水蒸气
D . 向所得溶液中加入过量  溶液最终会观察到有红褐色沉淀生成
溶液最终会观察到有红褐色沉淀生成
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A .  甲醇分子中含有的
甲醇分子中含有的 键数为4NA
B . 电解精炼铜,若阳极质量减少
键数为4NA
B . 电解精炼铜,若阳极质量减少 , 转移电子数一定为NA
C .
, 转移电子数一定为NA
C . 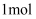 羟基含有的电子数为10NA
D .
羟基含有的电子数为10NA
D .  溶液中阴离子数大于0.1NA
溶液中阴离子数大于0.1NA
 甲醇分子中含有的
甲醇分子中含有的 键数为4NA
B . 电解精炼铜,若阳极质量减少
键数为4NA
B . 电解精炼铜,若阳极质量减少 , 转移电子数一定为NA
C .
, 转移电子数一定为NA
C . 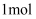 羟基含有的电子数为10NA
D .
羟基含有的电子数为10NA
D .  溶液中阴离子数大于0.1NA
溶液中阴离子数大于0.1NA
最近更新



