第二单元 物质的化学计量 知识点题库
NA为阿伏加德罗常数,下列说法正确的是( )
A . 1molC2H6中含有6 NA个共价键
B . 7.8 g Na2O2中含有的阳离子数和阴离子数均为0.2NA
C . 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA
D . 5.6g金属铁与足量盐酸反应时失去的电子数是0.3NA
设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A . 常温常压下,22.4LH2O中含有分子数为NA
B . 常温常压下,28gCO和N2的混合物所含的质子数为14NA
C . 1molCl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA
D . 常温下,1mol/L Na2CO3溶液中阴离子总数等于NA
在标准状况下,含有3.01×1023个分子的下列物质中,所占体积约为11.2L的是( )
A . N2
B . C
C . H2O
D . S
下列叙述中正确的是( )
A . 1.8 g的NH4+中含有的电子数为0.1×6.02×1023
B . 常温常压下,11.2 L氯气所含的原子数为6.02×1023
C . 常温常压下,18 g H2O含有的原子数为3×6.02×1023
D . 5.6 g金属铁变为离子时失去的电子数为0.2×6.02×1023
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A . 标准状况下,18gD2O中所含的质子数为10NA
B . 标准状况下,11.2LO2参加反应转移的电子数一定为2NA
C . 28gN2和CO的混合气体中含有的分子数为NA
D . 5.6g铁与足量稀硫酸反应失去电子数为0.3NA
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B . 常温常压下,200 g质量分数为17% 的H2O2溶液中含氧原子数目为NA
C . 7.1g氯气与足量NaOH溶液反应电子转移数为0.1NA
D . 标况下,4.48L的水中含有H2O分子的数目为0.2NA
NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 常温下pH=2的CH3COOH溶液中,H+的数目为0.01NA
B . 常温常压下,18 gD2O含有的质子数为10NA
C . 标准状况下,11.2 L乙烯和环丙烷(C3H6)的混合气体中,共用电子对数目为3NA
D . 0.1 molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
-
(1) 0.05 mol 的硫酸钠中含有个氧原子;与g NaCl中所含有的Na+数目相同。
-
(2) 质量都是50 g的 HCl、NH3、CO2、O2四种气体中,在相同温度和相同压强条件下,体积最大的是。(填分子式)
-
(3) 配制100 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O质量为 。
-
(4) 0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为。
设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A . 标准状况下,2.24 L H2O所含的原子数为0.5NA
B . 1mL 1mol/L NaCl溶液中离子总数为2NA
C . 18 g的H2O中含有的原子数为3NA
D . 标准状况下,22.4L氦气所含原子数为2 NA
科学家发现一种化学式为H3 的氢分子。1mol H3和1mol H2具有相同的( )
A . 原子数
B . 分子数
C . 质子数
D . 电子数
设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法中正确的是( )

A . 0.5mol雄黄(As4S4 , 结构如图)含有NA个S-S键
B . 合成氨工业中,投料1mol[N2(g)+3H2(g)]可生成2NA个[NH3(g)]
C . 一定条件下,足量氧气通过Na单质后,若固体增重3.2g,则转移的电子数一定为0.4NA
D . 58g正丁烷和异丁烷的混合物中共价键数目为13NA
下列说法中正确的是:( )
A . 1 mol O2 的质量为32 g/mol
B . Na+的摩尔质量为23
C . NH4HCO3的相对分子质量为79 g
D . 1 mol O2-的质量等于16 g
设 NA 为阿伏加德罗常数的值,下列说法正确的是( )
A . 反应 5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4L N2 时转移的电子数为3.75NA
B . 标准状况下甲烷和氧气的混合气体共22.4L,完全燃烧后的物质的分子总数一定为NA
C . 将1mol Cl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA(N表示粒子数)
D . 10g的D2O中含有的质子数与中子数分别为5NA 和4NA
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 2.0 g H218O与D2O的混合物中所含中子数为NA
B . 足量的铁粉与200 mL 1 mol •L-1的硝酸完全反应,生成H2的分子数为0.1NA
C . 0.1 mol Cl2通入含0.1 mol FeBr2的溶液中,被氧化的溴离子数为0.2NA
D . 标准状况下,2.24 L SO3分子数为0.1NA
设阿伏加德罗常数的值为NA。下列说法正确的是( )
A . pH=13的Ba(OH)3溶液中Ba2+数目为0.1NA
B . 标准状况下,1.12L苯含有C-H键的个数为3NA
C . 7.8gNa2S与7.8gNa2O2中含有的阴离子数目均为0.1NA
D . 1molCl2和Fe在一定条件下充分反应,转移电子数为3NA
具备化学学科素养,会提高分析问题和解决问题的能力。现有化学反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
根据上述反应回答下列问题:
-
(1) 该反应物H2C2O4 (草酸)中C的化合价为
-
(2) 标准状况下,3.36L CO2所含分子数为
-
(3) 2L K2SO4溶液中含有15.6g K+ , 则溶液中
 的物质的量浓度为
的物质的量浓度为
-
(4) 反应中需用0.10mol/L稀硫酸,用浓硫酸配制该浓度稀硫酸过程中,下列操作会导致所配浓度偏高的是______A . 转移时没有洗涤烧杯、玻璃棒 B . 未冷却到室温就转移至容量瓶定容 C . 摇匀后发现液面低于刻度线,又加蒸馏水至刻度线 D . 定容时俯视液面
-
(5) KMnO4是常见的氧化剂,而Fe2+具有还原性.在一支试管中加入少量KMnO4酸性溶液,然后向试管中加入少量FeSO4溶液,可以观察到的现象是 。当反应结束后,为了检验Fe3+ , 可以向试管中再滴加2滴,观察到的现象是。
1.5mol固体A在一定温度下完全分解,产物都是气体,反应的化学方程式为  ,若测得生成的混合气体与氢气相同条件下的密度比值为15,则固体A的摩尔质量为( )
,若测得生成的混合气体与氢气相同条件下的密度比值为15,则固体A的摩尔质量为( )
 ,若测得生成的混合气体与氢气相同条件下的密度比值为15,则固体A的摩尔质量为( )
,若测得生成的混合气体与氢气相同条件下的密度比值为15,则固体A的摩尔质量为( )
A . 30g/mol
B . 45 g/mol
C . 90 g/mol
D . 氢气密度未知,无法求得
某溶液中只可能含有H+、  、Mg2+、Al3+、
、Mg2+、Al3+、  、
、  、
、  中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
 、Mg2+、Al3+、
、Mg2+、Al3+、  、
、  、
、  中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( ) 
A . 溶液中的阳离子只有H+、Mg2+、Al3+
B . 溶液中n(  )=0.2 mol
C . 溶液中一定不含
)=0.2 mol
C . 溶液中一定不含  ,可能含有
,可能含有  和
和  D . n(H+):n(Al3+):n(Mg2+)=1:1:1
D . n(H+):n(Al3+):n(Mg2+)=1:1:1
 )=0.2 mol
C . 溶液中一定不含
)=0.2 mol
C . 溶液中一定不含  ,可能含有
,可能含有  和
和  D . n(H+):n(Al3+):n(Mg2+)=1:1:1
D . n(H+):n(Al3+):n(Mg2+)=1:1:1
NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 标准状况下,22.4LCHCl3中含有3NA个C-Cl键
B . 0.1molFeCl3与水反应生成的Fe(OH)3胶体中,分散质微粒数为0.1NA
C . 1molH2(g)与1molI2(g)在密闭容器中充分反应后,容器内分子数总数仍为2NA
D . 65gZn完全溶于酸性FeCl3溶液中生成0.01molH2时,转移的电子总数为0.02NA
含有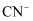 和重金属离子的废水均有剧毒,已知
和重金属离子的废水均有剧毒,已知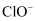 可用于处理含
可用于处理含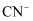 的废水,处理过程中体系存在
的废水,处理过程中体系存在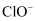 、
、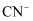 、
、 、
、 、
、 、
、 六种微粒。下列有关说法正确的是( )
六种微粒。下列有关说法正确的是( )
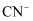 和重金属离子的废水均有剧毒,已知
和重金属离子的废水均有剧毒,已知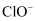 可用于处理含
可用于处理含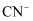 的废水,处理过程中体系存在
的废水,处理过程中体系存在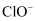 、
、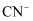 、
、 、
、 、
、 、
、 六种微粒。下列有关说法正确的是( )
六种微粒。下列有关说法正确的是( )
A . 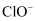 是氧化剂,氧化产物只有
是氧化剂,氧化产物只有 B . 反应配平后氧化剂与还原剂的化学计量数之比为5∶2
C . 若生成标准状况下2.24L
B . 反应配平后氧化剂与还原剂的化学计量数之比为5∶2
C . 若生成标准状况下2.24L , 则转移电子0.6mol
D . 含
, 则转移电子0.6mol
D . 含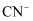 的废水也可用酸性
的废水也可用酸性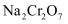 溶液处理
溶液处理
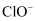 是氧化剂,氧化产物只有
是氧化剂,氧化产物只有 B . 反应配平后氧化剂与还原剂的化学计量数之比为5∶2
C . 若生成标准状况下2.24L
B . 反应配平后氧化剂与还原剂的化学计量数之比为5∶2
C . 若生成标准状况下2.24L , 则转移电子0.6mol
D . 含
, 则转移电子0.6mol
D . 含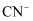 的废水也可用酸性
的废水也可用酸性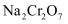 溶液处理
溶液处理
最近更新



