专题3 从海水中获得的化学物质 知识点题库

回答下列问题:
-
(1) 在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。
-
(2) “滤渣1”的主要成分有。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。
-
(3) 根据H3BO3的解离反应:H3BO3+H2O
 H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。
H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。
-
(4) 在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为,母液经加热后可返回工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是。
-
(1) 粗盐提纯的步骤有:①溶解;②过滤;③蒸发;④加盐酸调节溶液的pH;⑤加入过量的Na2CO3溶液;⑥加入过量的BaCl2溶液;⑦加入过量的NaOH溶液。正确的操作顺序是: 。
-
(2) ①上述过程中发生的所有化学方程式:;
②检验其中的SO42-的方法。
-
(1) 这两种元素名称分别是X,M。
-
(2) Y的简单离子结构示意图是;Z在周期表中的位置是 。
-
(3) X、Y、Z这三种元素的气态氢化物的稳定性由大而小的顺序是。
-
(4) X与Y形成的三原子分子甲的结构式是,Y与M形成的原子个数比为1:1的化合物乙的电子式是,甲与乙反应的化学方程式是 。
①0.1 mol·L-1CH3COOH溶液pH约为2.3
②0.1 mol·L-1 CH3COOH溶液的导电能力比相同条件下盐酸的弱
③相同条件下,把锌粒投入等浓度的盐酸和醋酸中,前者反应速率比后者快
④醋酸溶液中滴入石蕊试液变红,再加CH3COONH4固体,红色变浅
⑤常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合溶液呈酸性
⑥常温下,CH3COONa水溶液的pH>7
①使它转变成较易溶于水的物质 ②转变成较稳定、便于贮存的物质
③提高氯的质量分数 ④提高漂白能力

-
(1) 装置A中反应的离子方程式是。
-
(2) 装置B的作用是。
-
(3) 装置C中盛放的物质是。
-
(4) 装置D用于收集Cl2 , 请将图中装置D的导气管补充完整。
-
(5) 装置E用于吸收尾气,E中反应的离子方程式是。
| 选项 | 化学性质 | 实际应用 |
| A | | 漂白纸浆 |
| B | | 作供氧剂 |
| C | | 作矿物胶 |
| D | Al是活泼金属 | 铝质容器贮运浓硝酸 |
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
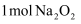 与足量
与足量  充分反应,转移的电子数为
充分反应,转移的电子数为  B .
B .  完全溶于一定量的浓硝酸,生成
完全溶于一定量的浓硝酸,生成  的分子数为2
的分子数为2  C . 将稀氨水滴入含
C . 将稀氨水滴入含  的溶液至中性,溶液中
的溶液至中性,溶液中  数目为
数目为  D . 标准状况下
D . 标准状况下  三氯甲烷中含共价键数为4
三氯甲烷中含共价键数为4 
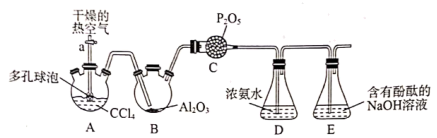
①按如图连接装置,检验装置的气密性,然后加装实验药品;
②打开活塞a.,向A中缓慢通入干燥的热空气;
③一段时间后,装置D中溶液会出现分层现象,且混合液上方有大量白色烟雾;
已知:3CCl4+Al2O3=3COCl2+2AlCl3
回答下列问题:
-
(1) 检验整个装置的气密性的方法:。
-
(2) 步骤②中通入干燥的热空气的作用为。
-
(3) 装置C的作用。
-
(4) 装置D中反应除生成尿素[CO(NH2)2]外,还有NH4Cl生成,该反应的化学方程式为。
-
(5) 分离装置D中混合液的操作名称为。
-
(6) 装置E中足量的NaOH溶液与少量的光气反应的离子方程式为:。
-
(7) 实验后,将D中溶液先蒸发结晶,再用重结晶的方法得到尿素晶体(含有少量的NH4Cl杂质),测定所得晶体中尿素的百分含量的方法:将7.07g晶体中所含氮完全转化为氨气所得氨气用100mL2.00mol•L-1的硫酸溶液完全吸收,取吸收液10mL用0.4000mol•L-1的氢氧化钠标准溶液滴定。
①到达滴定终点时,消耗氢氧化钠45.00mL,则该晶体中尿素的质量分数为(保留3位有效数字)。
②若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得该体晶中尿素的质量分数(选填“偏大”或“偏小”)。
 B . 能溶解Al(OH)3的溶液:Na+、K+、Cl-、
B . 能溶解Al(OH)3的溶液:Na+、K+、Cl-、  C . 无色透明溶液中:Al3+、Cu2+、Cl-、
C . 无色透明溶液中:Al3+、Cu2+、Cl-、  D . 1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、
D . 1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、 
 +2Ba2++4OH-=2BaSO4↓+2H2O+AlO
+2Ba2++4OH-=2BaSO4↓+2H2O+AlO  B . 电解MgCl2溶液:2H2O+2Cl-
B . 电解MgCl2溶液:2H2O+2Cl-  Cl2↑+H2↑+2OH-
C . Fe2(SO4)3溶液与H2S反应:2Fe2++3H2S=2FeS↓+S↓+6H+
D . 纯碱溶液中滴加溴水:2OH-+Br2=Br-+BrO-+H2O
Cl2↑+H2↑+2OH-
C . Fe2(SO4)3溶液与H2S反应:2Fe2++3H2S=2FeS↓+S↓+6H+
D . 纯碱溶液中滴加溴水:2OH-+Br2=Br-+BrO-+H2O
| 选项 | 陈述I | 陈述II | 判断 |
| A | Na2O2可为航天员供氧 | Na2O2能与CO2和水反应生成O2 | I对,II对,有 |
| B | NaHCO3可用于治疗胃酸过多 | NaHCO3可与盐酸反应 | I对,II对,无 |
| C | 向滴有酚酞的水中投入一定量的Na2O2 , 溶液变红色 | Na2O2与水反应生成氢氧化钠 | I对,II错,无 |
| D | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | I对,II对,有 |
①钠在空气中燃烧生成淡黄色的氧化钠
②钠投入硫酸铜溶液中有红色固体产生
③氢气在氯气中燃烧产生苍白色烟雾
④铁丝在氯气中燃烧生成棕黄色的FeCl3

关于I、II、III步溶液中导致变色的微粒的对应判断,正确的是( )
 B . SO2通入碘水中,反应的离子方程式为
B . SO2通入碘水中,反应的离子方程式为  C . 向烧碱溶液中通入过量的CO2:
C . 向烧碱溶液中通入过量的CO2:  D . 向小苏打溶液中加入过量石灰水:
D . 向小苏打溶液中加入过量石灰水: 
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
-
(1) 镁元素在周期表中的位置是。
-
(2) ②的最高价氧化物的结构式为。
-
(3) ④⑤元素可形成既含离子键又含非极性共价键的离子化合物,写出该化合物的电子式:;写出⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式。
-
(4) W是第四周期与④同主族的元素。据此推测W不可能具有的性质是____(填字母)。A.最高化合价为
 A . 简单气态氢化物比
A . 简单气态氢化物比 稳定
B . 最高价氧化物对应水化物的酸性比硫酸弱
C . 单质在常温下可与氢气化合
稳定
B . 最高价氧化物对应水化物的酸性比硫酸弱
C . 单质在常温下可与氢气化合
-
(5) 已知X为第ⅡA族元素(前四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数
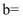 (用含a的代数式表示)。
(用含a的代数式表示)。
 具有还原性
具有还原性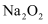 能与
能与  和水反应
和水反应 的水溶液具有碱性
的水溶液具有碱性


