专题3 从海水中获得的化学物质 知识点题库
能用H++OH-→H2O表示的是( )
A . NaHSO4+NaOH→Na2SO4+H2O
B . CH3COOH+NaOH→CH3COONa+H2O
C . H2SO4+Ba(OH)2→BaSO4↓+2H2O
D . NH3·H2O+HCl→NH4Cl+H2O
某试样含有的阳离子为NH4+、Ag+、Ba2+、Cu2+、Fe2+中的若干种,为确定其组成,某同学进行了如下实验,下列说法不正确的是( )

注:①CuS为难溶于水的黑色固体;②气体A能使湿润的红色石蕊试纸变蓝。
A . 沉淀A为BaSO4
B . 加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
C . 加入氨水-氯化铵溶液可使Fe3+沉淀完全,而Cu2+不形成沉淀
D . 试样中一定含NH4+、Ba2+、Cu2+、Fe2+ , 一定不含Ag+
下列有关化学符号表征正确的是( )
A . 电解法精炼铜,阴极电极反应:Cu2++2e-=Cu
B . H2S在水溶液中的电离:H2S  2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) =CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O
2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) =CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O  2OH-+H2CO3
2OH-+H2CO3
 2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) =CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O
2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) =CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O  2OH-+H2CO3
2OH-+H2CO3
室温下有下列四种溶液,下列叙述正确的是( )
| 编号 | ① | ② | ③ | ④ |
| pH | 3 | 3 | 11 | 11 |
| 溶液 | 盐酸 | 醋酸溶液 | 氢氧化钠溶液 | 氨水 |
A . ①、②、③三种溶液的物质的量浓度大小为:①=③>②
B . 相同体积的①、②溶液分别与③溶液完全中和,消耗③溶液的体积:①>②
C . ②、③两溶液等体积混合,所得溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D . ①、③溶液以体积比为9:11混合,则混合溶液的pH=4
请据以下物质回答下列问题(填序号)
①浓H2SO4②液态SO2③纯醋酸④硫酸氢钠固体⑤铜⑥NaOH溶液 ⑦熔融的KCl ⑧酒精
-
(1) 属于强电解的是
-
(2) 属于强电解质且在上述状态下能导电的是,属于非电解质但溶于水后能导电的是
-
(3) 写出下列物质在水中的电离方程式: 硫酸氢钠固体:醋酸:
工业制备下列物质的方案中正确的是( )
A .  B .
B .  C .
C . 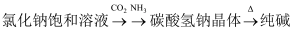 D .
D . 
 B .
B .  C .
C . 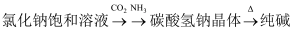 D .
D . 
下列各组离子反应可用H++OH-=H2O表示的是( )
A . 氢氧化钡和硫酸
B . 氢氧化铁和盐酸
C . 醋酸和氢氧化钠
D . 硝酸和氢氧化钠
Cl2O 是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸,一种制取 Cl2O 的装置如图所示。
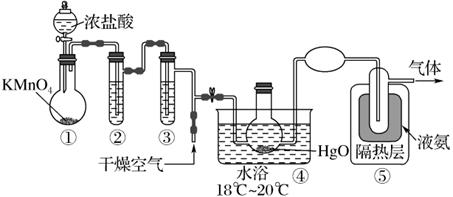
已知:Cl2O 的熔点为-116℃,沸点为3.8℃;NH3的沸点为-33.5 ℃;Cl2 的沸点为-34.6 ℃;HgO+2Cl2=HgCl2+Cl2O。下列说法中错误的是( )
A . 装置②、③中盛装的试剂依次是浓硫酸和饱和食盐水
B . 通入干燥空气的目的是将生成的Cl2O稀释减小爆炸危险
C . 从装置⑤中逸出气体的主要成分是 Cl2 和干燥空气,故末端应该有尾气处理装置
D . 装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
下列电离方程式书写错误的是( )
A . H2S  HS-+H+
B . H2SO3+H2O
HS-+H+
B . H2SO3+H2O  H3O++HSO
H3O++HSO  C . Mg(OH)2
C . Mg(OH)2  Mg2++2OH-
D . HCO
Mg2++2OH-
D . HCO  +H2O
+H2O  H2CO3+OH-
H2CO3+OH-
 HS-+H+
B . H2SO3+H2O
HS-+H+
B . H2SO3+H2O  H3O++HSO
H3O++HSO  C . Mg(OH)2
C . Mg(OH)2  Mg2++2OH-
D . HCO
Mg2++2OH-
D . HCO  +H2O
+H2O  H2CO3+OH-
H2CO3+OH-
已知  为阿伏加德罗常数的值,下列说法错误的是( )
为阿伏加德罗常数的值,下列说法错误的是( )
 为阿伏加德罗常数的值,下列说法错误的是( )
为阿伏加德罗常数的值,下列说法错误的是( )
A .  中含有的中子数为
中含有的中子数为  B .
B . 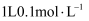 碳酸钠溶液中含有的
碳酸钠溶液中含有的  数目为
数目为  C .
C .  被还原为
被还原为  时,当生成
时,当生成  ,转移的电子数为
,转移的电子数为 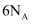 D .
D . 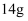 乙烯中含有的共用电子对的数目为
乙烯中含有的共用电子对的数目为 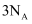
 中含有的中子数为
中含有的中子数为  B .
B . 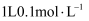 碳酸钠溶液中含有的
碳酸钠溶液中含有的  数目为
数目为  C .
C .  被还原为
被还原为  时,当生成
时,当生成  ,转移的电子数为
,转移的电子数为 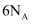 D .
D . 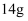 乙烯中含有的共用电子对的数目为
乙烯中含有的共用电子对的数目为 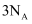
N A 表示阿伏加德罗常数的值,下列判断正确的是( )
A . 10gH218O 含有的中子数为 5 NA
B . 0.5 mol·L-1 Al2(SO4)3溶液中阳离子所带电荷数为 3 NA
C . 常温下,1 mol 浓硝酸与足量 Al 反应,转移电子数为 3 NA
D . 标准状况下,5.6 L Cl2溶于水配成 1 L 溶液,溶液中 Cl-数为 0.25 NA
下列“类比”合理的是( )
A . Fe与S反应生成FeS,则Cu与S反应生成Cu2S
B . C在足量的O2中燃烧生成CO2 , 则S在足量的O2中燃烧生成SO3
C . Cl2与水反应生成HCl和HClO,则F2与水反应生成HF和HFO
D . Na2O2与CO2反应生成Na2CO3和O2 , 则Na2O2与SO2反应生成Na2SO3和O2
下列指定反应的离子方程式正确的是( )
A . 酸性溶液中KIO3与KI反应生成I2: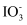 +I-+6H+=I2+3H2O
B . 石灰石和稀盐酸制取CO2气体:
+I-+6H+=I2+3H2O
B . 石灰石和稀盐酸制取CO2气体: +2H+=CO2↑+H2O
C . 等体积、等物质的量浓度的Ba(OH)2与NaHSO4溶液反应:Ba2++OH-+H++
+2H+=CO2↑+H2O
C . 等体积、等物质的量浓度的Ba(OH)2与NaHSO4溶液反应:Ba2++OH-+H++ =BaSO4↓+H2O
D . 少量铁粉加入足量稀硝酸中:3Fe+8H++2
=BaSO4↓+H2O
D . 少量铁粉加入足量稀硝酸中:3Fe+8H++2 =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
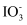 +I-+6H+=I2+3H2O
B . 石灰石和稀盐酸制取CO2气体:
+I-+6H+=I2+3H2O
B . 石灰石和稀盐酸制取CO2气体: +2H+=CO2↑+H2O
C . 等体积、等物质的量浓度的Ba(OH)2与NaHSO4溶液反应:Ba2++OH-+H++
+2H+=CO2↑+H2O
C . 等体积、等物质的量浓度的Ba(OH)2与NaHSO4溶液反应:Ba2++OH-+H++ =BaSO4↓+H2O
D . 少量铁粉加入足量稀硝酸中:3Fe+8H++2
=BaSO4↓+H2O
D . 少量铁粉加入足量稀硝酸中:3Fe+8H++2 =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
实验室按如下装置测定纯碱(含少量NaCl)的纯度。下列说法不正确的是( )
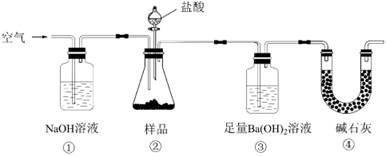
A . 必须在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶
B . 装置①、④的作用是防止空气中的CO2进入装置③
C . 滴入盐酸前,应将装置中含有CO2的空气排尽
D . 反应结束时,应再通入空气将装置②中CO2转移到装置③中
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如图所示:

通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
-
(1) Cl2与NaOH溶液反应的化学方程式是;
-
(2) KI溶液变为黄色说明氯气具有性,该反应的离子方程式是;
-
(3) 已知
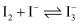 ,
, 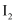 、
、 在水中均呈黄色。为确定黄色溶液的成分,进行以下实验:
在水中均呈黄色。为确定黄色溶液的成分,进行以下实验:操作
实验现象
a
取2~3mL黄色溶液,加入足量
 , 振荡静置
, 振荡静置 层呈紫红色,水层显浅黄色
层呈紫红色,水层显浅黄色b
取2~3mL饱和碘水,加入足量
 , 振荡静置
, 振荡静置 层呈紫红色,水层几近无色
层呈紫红色,水层几近无色①实验b的目的是;
②根据实验a可知,水层中含有的粒子有;
③用化学平衡原理解释实验a中水溶液颜色变浅的原因:;
-
(4) 通入氯气,溶液由黄色变为无色,是因为氯气将
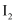 氧化。已知
氧化。已知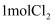 可氧化
可氧化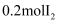 , 该反应的离子方程式是;
, 该反应的离子方程式是;
-
(5) 根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为;
-
(6) 溶液最终变为浅黄绿色的原因是。
某溶液可能含有Al3+、NH 、Fe2+、Na+、CO
、Fe2+、Na+、CO 、SO
、SO 、Cl-、NO
、Cl-、NO 中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对
中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对 溶液进行如图实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)( )
溶液进行如图实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)( )
 、Fe2+、Na+、CO
、Fe2+、Na+、CO 、SO
、SO 、Cl-、NO
、Cl-、NO 中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对
中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对 溶液进行如图实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)( )
溶液进行如图实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)( )
A . 原溶液中一定存在NH 、Fe2+、SO
、Fe2+、SO B . 原溶液中可能含有NO
B . 原溶液中可能含有NO 和Al3+
C . 白色沉淀C可能是Al(OH)3
D . 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
和Al3+
C . 白色沉淀C可能是Al(OH)3
D . 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
 、Fe2+、SO
、Fe2+、SO B . 原溶液中可能含有NO
B . 原溶液中可能含有NO 和Al3+
C . 白色沉淀C可能是Al(OH)3
D . 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
和Al3+
C . 白色沉淀C可能是Al(OH)3
D . 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
下列离子方程式书写错误的是( )
A . 向硅酸钠溶液中加入稀硫酸: B . 向氯化铝溶液中加入过量氨水:
B . 向氯化铝溶液中加入过量氨水: C . 碘单质与浓氢氧化钠溶液反应:
C . 碘单质与浓氢氧化钠溶液反应: D . 氯气与水反应:
D . 氯气与水反应:
 B . 向氯化铝溶液中加入过量氨水:
B . 向氯化铝溶液中加入过量氨水: C . 碘单质与浓氢氧化钠溶液反应:
C . 碘单质与浓氢氧化钠溶液反应: D . 氯气与水反应:
D . 氯气与水反应:
下列反应的离子方程式书写正确的是( )
A . 硫酸铁溶液与硫氰化钾溶液混合:Fe3+ +3SCN-=Fe(SCN)3↓
B . 锌粒投入稀硝酸中:Zn + 2H+ =Zn2+ +H2↑
C . 氯化铵溶液中滴入氢氧化钠溶液:NH4++OH-=NH3↑+H2O
D . 乙酸乙酯与氢氧化钠溶液混合加热:CH3COOCH2CH3+OH- CH3COO-+CH3CH2OH
CH3COO-+CH3CH2OH
 CH3COO-+CH3CH2OH
CH3COO-+CH3CH2OH
化学与生产、生活密切相关,下列物质的性质、用途都正确且有相关性的是( )
|
选项 |
性质 |
用途 |
|
A |
CCl4难溶于水,难于燃烧 |
CCl4常用作有机溶剂和灭火剂 |
|
B |
Al2O3既能与强酸反应,又能与强碱反应 |
Al2O3常用作耐高温材料 |
|
C |
SiO2透明,折射率合适,能够发生全反射 |
SiO2用作光导纤维材料 |
|
D |
Cl2具有漂白性 |
常用Cl2对自来水进行杀菌消毒 |
A . A
B . B
C . C
D . D
下列离子方程式书写正确的是( )
A . 硫酸钠溶液与氢氧化钡反应: B . 次氯酸钠溶液中通入过量
B . 次氯酸钠溶液中通入过量 时:
时: C . 碳酸氢钠溶于过量稀盐酸中:
C . 碳酸氢钠溶于过量稀盐酸中: D . 碳酸银溶于过量盐酸中:
D . 碳酸银溶于过量盐酸中:
 B . 次氯酸钠溶液中通入过量
B . 次氯酸钠溶液中通入过量 时:
时: C . 碳酸氢钠溶于过量稀盐酸中:
C . 碳酸氢钠溶于过量稀盐酸中: D . 碳酸银溶于过量盐酸中:
D . 碳酸银溶于过量盐酸中:
最近更新



