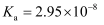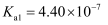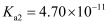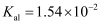专题3 从海水中获得的化学物质 知识点题库
17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:
-
(1) 10 mol/L的盐酸的质量分数
-
(2) 产生的气体在标准状况下的体积;
-
(3) 产生沉淀的质量。
按要求完成填空。
-
(1) 等物质的量的盐酸、苛性钠溶液分别与两份足量的铝粉反应,在相同条件下产生氢气的体积之比为
-
(2) 除去NaHCO3溶液中的Na2CO3杂质应,离子方程式为
-
(3) 将一小块金属钠投入到FeCl3溶液中,此时观察到的现象是 ,有关化学反应方程式是
图为周期表的一部分,表中所列字母分别代表周期表对应的化学元素,针对所列元素回答问题

-
(1) 元素C在周期表的位置是
-
(2) 元素A和B形成的二元化合物中,能标志一个国家石油化学工业发展水平的(填化学式),该物质使溴的四氯化碳溶液褪色的化学方程式为
-
(3) 能形成两性氢氧化物的元素是(填元素符号)。
-
(4) 元素G 、H 、I形成的简单离子中,半径最大的是(填离子符号)。
-
(5) E单质在H单质中燃烧的现象是,生成物的电子式为
-
(6) 元素C和D的最简单氢化物中,沸点比较高的是(填化学式);E和D形成的化合物E2D2和水反应的化学方程式是
有A、B、C、D四种化合物,分别由K+、Ba2+、SO  、CO
、CO  、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与稀硫酸反应生成A;④D可溶于水,与稀硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与稀硫酸反应生成A;④D可溶于水,与稀硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
 、CO
、CO  、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与稀硫酸反应生成A;④D可溶于水,与稀硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无色无味的气体E;③C的水溶液呈碱性,与稀硫酸反应生成A;④D可溶于水,与稀硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
-
(1) 推断A、C的化学式:A ;C ;
-
(2) 写出下列反应的离子方程式。
①D与氯化钙反应:。
②B与盐酸反应: 。
③C与稀硫酸反应:。
下列离子方程式中,错误的是( )
A . 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B . 氯化钡溶液与硫酸反应:Ba2++  =BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
=BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
 =BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
=BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
下列叙述中正确的是( )
A . 强电解质溶液的导电性一定比弱电解质溶液的导电性强
B . 稀盐酸溶液能导电,所以稀盐酸是电解质
C . 二氧化硫溶于水能导电,故二氧化硫属于电解质
D . 硫酸钡虽然难溶于水,但硫酸钡属于电解质
NO、NO2、O2按照一定比例通入水中,能被完全吸收,无剩余气体,若NO、NO2、O2的气体体积分别为x,y,z则x;y;z;不可能为( )
A . 2:6:3
B . 1:1:1
C . 6;2:5
D . 3:6:4
1L稀硝酸和稀硫酸的混合溶液中,硝酸和硫酸的物质的量浓度均为  。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
 。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3 和 PbI2 在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是( )

A . Ksp(PbCO3)的数量级为 10-14
B . 相同条件下,水的电离程度 p 点大于 q 点
C . L1 对应的是-lgc(Pb2+)与-lgc(I-)的关系变化
D . p 点溶液中加入 Na2CO3 浓溶液,可得白色沉淀
化学与生产、生活息息相关.下列说法正确的是( )
A . 对含硫燃料预先进行脱硫处理能从根本上防止硫酸型酸雨的产生
B . 漂白粉的主要成分是次氯酸钙,应密封保存
C . 光导纤维的主要材质是硅
D . 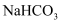 是焙制糕点所用发酵粉的主要成分之一,也是医疗上治疗胃酸过多的一种药剂
是焙制糕点所用发酵粉的主要成分之一,也是医疗上治疗胃酸过多的一种药剂
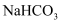 是焙制糕点所用发酵粉的主要成分之一,也是医疗上治疗胃酸过多的一种药剂
是焙制糕点所用发酵粉的主要成分之一,也是医疗上治疗胃酸过多的一种药剂
某溶液中可能含有 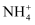 、K+、Ba2+、Fe3+、I-、
、K+、Ba2+、Fe3+、I-、  、
、  中的几种,现取l00rnL溶液加入少量溴水,溶液呈无色。继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH溶液、加热,生成气体在标准状况下体积为1120rnL。(已知还原性:
中的几种,现取l00rnL溶液加入少量溴水,溶液呈无色。继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH溶液、加热,生成气体在标准状况下体积为1120rnL。(已知还原性:  >I-)根据上述实验,以下推测正确的是( )
>I-)根据上述实验,以下推测正确的是( )
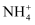 、K+、Ba2+、Fe3+、I-、
、K+、Ba2+、Fe3+、I-、  、
、  中的几种,现取l00rnL溶液加入少量溴水,溶液呈无色。继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH溶液、加热,生成气体在标准状况下体积为1120rnL。(已知还原性:
中的几种,现取l00rnL溶液加入少量溴水,溶液呈无色。继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g。滤液加足量NaOH溶液、加热,生成气体在标准状况下体积为1120rnL。(已知还原性:  >I-)根据上述实验,以下推测正确的是( )
>I-)根据上述实验,以下推测正确的是( )
A . 原溶液肯定只存在 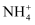 、
、  B . 原溶液一定不含Ba2+、Fe3+、I-
C . 原溶液可能存在K+、
B . 原溶液一定不含Ba2+、Fe3+、I-
C . 原溶液可能存在K+、  D . 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成
D . 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成
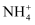 、
、  B . 原溶液一定不含Ba2+、Fe3+、I-
C . 原溶液可能存在K+、
B . 原溶液一定不含Ba2+、Fe3+、I-
C . 原溶液可能存在K+、  D . 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成
D . 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成
某实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:①蒸馏时各组分的沸点差异越大,分离效果越好;②可能用到的装置和数据如下:
| 物质 | Br2 | CCl4 | 乙苯 |
| 密度(g/cm3) | 3.12 | 1.60 | 0.87 |
| 沸点(℃) | 58.8 | 76.8 | 136.2 |
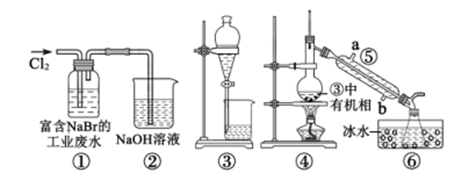
下列说法错误的是( )
A . ②的作用是吸收多余Cl2 , 防止空气污染
B . 用③进行萃取时,选择CCl4比乙苯更合理
C . 乙苯和CCl4萃取Br2时现象都是分层,上层无色,下层橙色
D . 仪器⑤的名称为冷凝管,其中b为进水口,a为出水口
下列反应的离子方程式书写正确的是( )
A . 钠与水反应:Na +H2O=Na++OH-+ H2↑
B . 铁粉与稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑
C . Cu(OH)2固体与稀H2SO4反应:OH-+H+=H2O
D . Na2CO3溶液与足量盐酸反应:CO  +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
 +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
下列关于钠及其化合物的说法中,错误的是( )
A . 金属钠可以保存在石蜡油中
B . 等质量的  与
与  分别与足量的盐酸反应,
分别与足量的盐酸反应,  产生的
产生的  更多
C . 可以用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
D . 向
更多
C . 可以用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
D . 向  中加入少量水后,
中加入少量水后,  能溶解,并伴随着吸热现象
能溶解,并伴随着吸热现象
 与
与  分别与足量的盐酸反应,
分别与足量的盐酸反应,  产生的
产生的  更多
C . 可以用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
D . 向
更多
C . 可以用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
D . 向  中加入少量水后,
中加入少量水后,  能溶解,并伴随着吸热现象
能溶解,并伴随着吸热现象
将7.8g Na2O2投入水中充分反应,最终形成500ml溶液。求:
-
(1) Na2O2的物质的量?
-
(2) 反应后溶液中溶质的物质的量?
-
(3) 反应后溶液中溶质的物质的量浓度?
-
(4) 产生气体标况下的体积?
已知部分弱酸的电离常数如表所示:
| 弱酸 | HClO | | |
| 电离常数 ( | | | |
下列离子方程式正确的是( )
A . 少量  通入NaClO溶液中:
通入NaClO溶液中: 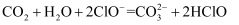 B . 少量
B . 少量  通入
通入 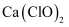 溶液中:
溶液中: 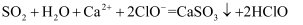 C . 少量
C . 少量  通入
通入  溶液中:
溶液中: 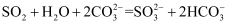 D . 相同浓度
D . 相同浓度  溶液与
溶液与  溶液等体积混合:
溶液等体积混合: 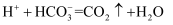
 通入NaClO溶液中:
通入NaClO溶液中: 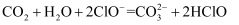 B . 少量
B . 少量  通入
通入 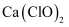 溶液中:
溶液中: 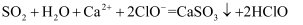 C . 少量
C . 少量  通入
通入  溶液中:
溶液中: 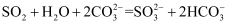 D . 相同浓度
D . 相同浓度  溶液与
溶液与  溶液等体积混合:
溶液等体积混合: 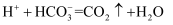
现有一混合物的水溶液,可能含有以下离子中的几种:K+、 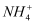 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、  、
、 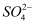 。现取三份各100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。正确的是( )
。现取三份各100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。正确的是( )
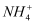 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、  、
、 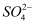 。现取三份各100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。正确的是( )
。现取三份各100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。正确的是( )
A . 该混合液中一定含有:K+、 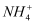 、
、  、
、 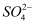 ,可能含Cl- , 且c(K+)≥0.4mol/L
B . 该混合液中一定含有:
,可能含Cl- , 且c(K+)≥0.4mol/L
B . 该混合液中一定含有: 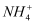 、
、  、
、 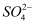 ,可能含K+、Cl-
C . 该混合液中一定含有:
,可能含K+、Cl-
C . 该混合液中一定含有: 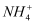 、
、  、
、 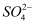 ,可能含Mg2+、K+、Cl-
D . 该混合液中一定含有:
,可能含Mg2+、K+、Cl-
D . 该混合液中一定含有: 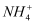 、
、 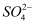 ,可能含Mg2+、Cl-
,可能含Mg2+、Cl-
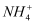 、
、  、
、 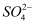 ,可能含Cl- , 且c(K+)≥0.4mol/L
B . 该混合液中一定含有:
,可能含Cl- , 且c(K+)≥0.4mol/L
B . 该混合液中一定含有: 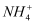 、
、  、
、 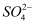 ,可能含K+、Cl-
C . 该混合液中一定含有:
,可能含K+、Cl-
C . 该混合液中一定含有: 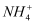 、
、  、
、 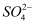 ,可能含Mg2+、K+、Cl-
D . 该混合液中一定含有:
,可能含Mg2+、K+、Cl-
D . 该混合液中一定含有: 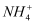 、
、 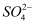 ,可能含Mg2+、Cl-
,可能含Mg2+、Cl-
氧化还原反应在物质制备、能量转化方面有重要的应用。
-
(1) 用单线桥法表示下列反应的电子转移方向和数目。

-
(2) 反应
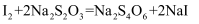 常用于测定溶液中I2的含量。反应的还原剂是,每生成1moLNaI,反应转移电子mol。
常用于测定溶液中I2的含量。反应的还原剂是,每生成1moLNaI,反应转移电子mol。
-
(3) 反应 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中氧化剂与还原剂的物质的量之比为。
-
(4) 高铁酸钾(K2FeO4)可作为高效、多功能水处理剂。用FeCl3与KClO在强碱条件下反应可制取高铁酸钾,完成反应的离子方程式。
2Fe3++_ClO-+_OH-=_FeO
 +3Cl-+_
+3Cl-+_
KMnO4是常用的消毒剂和氧化剂。已知相关化学反应如下:
①实验室制O2:
②实验室制Cl2:
③测定废水中Mn2+:
下列说法不正确的是( )
A . 加热1 mol KMnO4固体一段时间后剩余固体再与足量浓盐酸充分加热产生气体的物质的量n: B . 可用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
B . 可用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: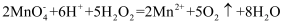 C . 结合已有知识,通过②反应可判断KMnO4氧化能力强于MnO2
D . ③中生成3 mol氧化产物时转移6 mol电子
C . 结合已有知识,通过②反应可判断KMnO4氧化能力强于MnO2
D . ③中生成3 mol氧化产物时转移6 mol电子
 B . 可用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
B . 可用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: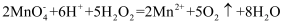 C . 结合已有知识,通过②反应可判断KMnO4氧化能力强于MnO2
D . ③中生成3 mol氧化产物时转移6 mol电子
C . 结合已有知识,通过②反应可判断KMnO4氧化能力强于MnO2
D . ③中生成3 mol氧化产物时转移6 mol电子
下列有关离子(或物质)的检验及结论正确的是( )
A . 无色溶液加入 溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无
溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无 B . 向无色溶液中加入
B . 向无色溶液中加入 溶液有白色沉淀出现,则溶液中一定含有
溶液有白色沉淀出现,则溶液中一定含有 C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
 溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无
溶液,用湿润的红色石蕊试纸放试管口未变蓝,则原溶液中无 B . 向无色溶液中加入
B . 向无色溶液中加入 溶液有白色沉淀出现,则溶液中一定含有
溶液有白色沉淀出现,则溶液中一定含有 C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
C . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定是钠盐
D . 向某溶液中加入稀盐酸产生使澄清石灰水变浑浊的气体,则溶液中可能含有
最近更新

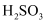
 )
)