实验方案设计与评价 知识点题库
 B . 探究水的运输部位
B . 探究水的运输部位 C . 组装省力到1/3的滑轮组
C . 组装省力到1/3的滑轮组 D . 验证酶的专一性
D . 验证酶的专一性
用隔板将玻璃容器均分为两部分,隔板中有一小孔用薄橡皮膜封闭(如图)。下列问题中可以用该装置探究的是( )

①液体压强是否与液体的深度有关
②液体压强是否与液体的密度有关
③液体是否对容器的底部产生压强
④液体是否对容器的侧壁产生压强
塑料袋 | 塑料袋口 | 环境湿度 | 环境温度 |
甲 | 结扎袋口 | 干燥 | 温暖 |
乙 | 结扎袋口 | 潮湿 | 低温 |
A.可能跟物体浸入液体的深度有关; B.可能跟物体的重力有关;
C.可能跟物体浸入液体的体积有关; D.可能跟液体的密度有关。
为了验证上述猜想,李明做了如图所示的实验:他在弹簧测力计下端挂一个铁块或铜块,
依次把它们缓缓地浸入水中不同位置,在这一实验中:

-
(1) 铁块从位置③→④的过程中,弹簧测力计的示数减小,说明铁块受到浮力(选填“变大”、“变小”或“不变”),可以验证猜想是正确的(选填“A”、“B”、“C”、“D”)。
-
(2) 从位置④→⑤的过程中,弹簧测力计的示数不变,说明铁块受到的浮力不变,可以验证猜想是错误的(选填“A”,“B”,“C”,“D”)。
-
(3) 分析比较实验①⑤与②⑥,可以验证猜想是错误的(选填“A”,“B”,“C”,“D”)。
-
(4) 分析比较实验可得:浸在液体中的物体所受浮力的大小与液体的密度有关。
-
(5) 该实验探究主要运用的科学探究方法是:。

-
(1) 小敏测量大理石样品的方案有 2 种,根据以下 2 种方案的数据你认为哪一种测量方案设计更合理:(选填:“方案 1”,“方案 2”。)理由是:
-
(2) 小华取10克石灰石样品,用如图乙实验装置进行实验,加入足量的盐酸反应结束后,测得C装置收集二氧化碳气体体积换算为质量后是2.2克,根据上述数据,算得石灰石样品含碳酸钙的质量分数是多少?

-
(3) 对图乙,小华的实验方案的评价合理的是 :A . 稀盐酸换成稀硫酸也可以完成本实验 B . 收集的二氧化碳气体可以不用浓硫酸干燥 C . A 装置中残留的二氧化碳对实验测量结果没影响 D . 装置 C 在开始收集气体前必须装满液体,不能留有空气

取样品10克,得到如下A、B两组数据:
| 反应前 | 完全反应后 | |
| A组 | 玻璃管和氧化铜样品的质量共42.5克 | 玻璃管和固体物质的质量共40.9克 |
| B组 | U形管和其中物质的质量共180.0克 | U形管和其中物质的质量共182.3克 |
请回答下列问题:
-
(1) 为保证实验安全,在点燃酒精灯前的一步实验操作是,实验中可以看到B中的现象是
-
(2) 通过两组数据分析计算得到的结果不一样,其原因是 。
【查阅资料】Ⅰ.钙、氢化钙遇水立即发生剧烈反应:
Ca+2H2O=Ca(OH)2+H2↑; CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅱ.钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水。
【实验原理】用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2 . 同学们设计了以下实验装置:

-
(1) 图1实验设计图,为了实验安全,点燃C装置酒精灯前,应采取的操作为;D装置的作用是
-
(2) 反应结束后,小组同学想证明C中的钙是否真变成氢化钙,设计如下定性实验:取图C中少量反应后的固体样品,在干燥条件下与氧气反应,再将其产物通入图2中的(选填①或②)装置。
-
(3) 既然钙与氢化钙两种固体均能与水反应生成氢气能源,那为什么要将金属钙制备成氢化钙作为登山运动员常用的能源提供剂呢?请亮出你的解释

部分实验步骤如下:
Ⅰ.将质量为m的样品放入硬质玻璃管中,称量装置B的质量。
Ⅱ.连接好装置。缓缓通入N2一会儿,再开始加热并控制温度在100℃左右。反应结束后称量装置B的质量。
Ⅲ.重复步骤Ⅱ,控制温度在550℃左右。反应结束后再次称量装置B的质量。实验数据记录如下表:
| 温度/℃ | 室温 | 100 | 550 |
| B装置/g | m1 | m2 | m3 |
请回答下列问题:
-
(1) 如果装置B中的试剂也是浓硫酸,那么装置C的作用是。
-
(2) 每次停止加热后仍需继续通N2 , 作用是。(写出两点)
-
(3) 样品中Cu(OH)2的质量分数为。若步骤Ⅱ中物质反应不完全,则样品中Fe(OH)3的质量分数会(“偏大”或“偏小”或“无影响”)。

-
(1) 实验开始时,首先通入一段时间的氧气,其理由是。
-
(2) 以下装置中需要加热的仪器有A和D两处,操作时应先点燃处的酒精灯。
-
(3) 实验测得B、C装置分别增重m1克和m2克,则该物质化学式中x、y比值为。
-
(4) 将B和C装置互换,则测得的氢元素的含量会(选填“偏大”“偏小”或“不变”)。

⑴用天平称取少量新鲜土壤,记录质量为M1;
⑵把他们放在铁丝网上用酒精灯灼烧,如图所示;
⑶用一个干冷的烧杯罩在土壤上,观察发现有现象;
⑷用涂有澄清石灰水的烧杯罩在土壤上,观察发现有现象;
⑸待土壤冷却后测得质量为M2。小金认为有机物的质量就是M1-M2同桌小明则认为,该方案考虑不周,需要对其中一个步骤进行修改,请写出修改的内容
【猜想】猜想一:可能是NaCl和NaOH;猜想二:可能只有NaCl;
猜想三:
【进行实验】
|
实验步骤 |
实验操作 |
实验现象 |
结论 |
|
① |
取少量烧杯内的溶液于试管中,滴入几滴酚酞试液,振荡 |
|
猜想一不成立 |
|
② |
取少量烧杯内的溶液于另一支试管中,滴加碳酸钠溶液 |
|
猜想三成立 |
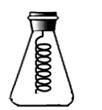

设计思路:用空气将装置B中生成的二氧化碳缓缓吹入装置D中,利用装置D的质量变化测定食用碱中Na2CO3的含量。请结合实验装置和设计思路,回答下面问题:
-
(1) 装置D中发生反应的化学方程式为;
-
(2) 若空气通入太快,会导致测定结果(填“偏大”或“偏小”);
-
(3) 装置A的作用是;
-
(4) 若没有C装置,会导致测定结果(填“偏大”或“偏小”)。
|
编号 |
① |
② |
③ |
④ |
|
试剂 |
NaOH 溶液 |
MgCl2 溶液 |
Na2CO3 溶液 |
Ba(NO3)2 溶液 |
|
加入稀硫酸 |
无明显现象 |
无明显现象 |
产生气泡 |
白色沉淀生成 |
-
(1) 以上实验中,③④出现了明显的现象,可以判断试管中发生了反应。(填基本反应类型)
-
(2) 小蓉同学向盛有 NaOH溶液的试管中先加了一种试剂,再逐滴加入稀硫酸,出现了红色消失的现象,确定试管①中也发生了反应,这种试剂是。
-
(3) 小蓉同学认为试管②中没有发生复分解反应,溶液中同时存在 Mg2+和 Cl-。
【查阅资料】SO42-会对Cl-的检验有干扰,需要先除去。

【设计方案】小蓉根据资料和自己的猜想提出了如下实验方案。
①小蓉的实验方案存在缺陷,请你加以改进。
②步骤三中现象Ⅱ的现象是:。

-
(1) 方法一:差量法。称取W克样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并利用测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用。
-
(2) 方法二:沉淀法。称取15克样品完全溶解于水中配成60克样品溶液,取三个烧杯分三次进行实验,每次加入30克氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表。计算样品中碳酸钠的质量分数。(Na2CO3+CaCl2=CaCO3↓+2NaCl) 。
烧杯 1
烧杯 2
烧杯 3
样品溶液(克)
10
20
30
氯化钙溶液(克)
30
30
30
沉淀质量(克)
2
4
5
-
(3) 请写出提高方法一测量精确度的操作建议(写出2条)


-
(1) 检查气密性。关闭阀门A和B,让1中液体进入到容器2中。虚线框所在装置,发生的反应的化学方程式是。
-
(2) 容器2中充满氢气后,打开阀门A,关闭阀门B,应出现的现象是。
-
(3) 实验完毕关闭阀门A和B,制得的Fe(OH)2在容器(选填“3”或“4”)中。
-
(4) 本实验中所有配制溶液的水需煮沸,容器2、3均密闭,其主要原因是 。

-
(1) 本实验是通过比较来比较酶的活性。
-
(2) 根据实验装置,写出本实验的步骤。
-
(1) 若通过比较相同时间内产生气体的体积来比较反应快慢,下列装置可行的是 。A .
 B .
B .  C .
C . 
-
(2) 小洁同学认为气离子对铝和酸的反应有促进作用,于是向铝片和硫酸的反应中滴入少量的盐酸,观察到反应变快,并重复多次。该实验方案存在的缺陷主要是。
-
(3) 小江同学进行实验并记录如表所示,则可得出结论:
组别
实验材料
添加试剂
现象
备注
Ⅰ
Al+HCl
/
++
“++”较“ +”表示化学反应速度更快
Ⅱ
Al+H2SO4
/
+
Ⅲ
Al+ HCl
少量Na2SO4
++
Ⅳ
Al+H2SO4
少量NaCl
++
|
组别 |
A |
B |
C |
|
蚕卵数 |
900 |
1000 |
800 |
|
培养温度 |
16℃ |
20℃ |
30℃ |
|
培养湿度 |
75% |
75% |
75% |
|
孵化出蚕幼虫所需的时间 |
10天 |
10天 |
10天 |
|
孵化率 |
90% |
98% |
68% |
请回答下列问题:
-
(1) 针对该实验,同学们做出的假设是
-
(2) 从探究方案分析,这个实验的变量是温度。从实验结果来看,最适宜蚕卵孵化的温度是
-
(3) 通过该实验可以得出的结论是:
-
(4) 有人认为A、B、C三个组中蚕卵数量应该相同。请你评判该观点并说明你的理由:



