复分解反应及其应用 知识点题库
图中的A~H是初中化学常见的化合物,且分别是由H、O、S、Na、Ca、Cu中的两种或三种元素组成的.其中B、E是氧化物,E中两种元素质量之比为2:3,C、F、H为相同类别的化合物,F易溶于水并放出大量的热,G的溶液呈蓝色,图中“﹣﹣”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系,部分反应物、生成物或反应条件已略去.

-
(1) G的化学式为 .
-
(2) 写出E和F反应的化学方程式 .
-
(3) G和H反应的基本反应类型为 .
-
(4) 写出C→B发生分解反应的化学方程式 .
分析推理是化学学习中常用的思维方法.下列说法正确的是( )
A . 酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定是酸
B . 有机物都含有碳元素,所以含有碳元素的化合物一定是有机物
C . 单质是由同种元素组成的,但同种元素组成的物质不一定是单质
D . 复分解反应中有沉淀或气体或水生成,所以有上述物质生成的反应就是复分解反应
科学课上,老师告诉学生“能发生复分解反应的两种盐通常是可溶的”。有“通常”就有“例外”,能否找到某些可溶性盐和难溶性盐发生复分解反应的证据呢?科学兴趣小组进行了探究。
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
②了解到某些难溶性盐的溶解能力和颜色,其中AgI是一种难溶于水的黄色沉淀。
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】
-
(1) 为什么要加入过量的NaCl溶液?请说明理由。
-
(2) 写出加入少量KI溶液后发生反应的化学方程式。
-
(3) 该反应能发生的原因是AgI在水中的溶解能力AgCl(选填“大于”、“等于”或“小于”)。
图中的几种物质是常见的盐,请回答下列问题:

-
(1) 碳酸钙、碳酸钠均能与稀盐酸反应生成 CO2 , 是因为碳酸钙、碳酸钠中均含有(写离子符号)。
-
(2) 硫酸铜溶液与氯化钠溶液不能反应,其理由是。
某科学小组同学从微观角度进一步理解复分解反应的实质。复分解反应的实质是某些阴、阳离子结合生成沉淀、气体或水的过程。根据复分解反应的实质,形成一个复分解反应网络图,如下图,其中直线相连的阴、阳离子之间能够两两结合发生反应。请选择合适的离子填入下图括号内,使其两两结合时,一个有气体产生,一个生成沉淀(沉淀为大理石的主要成分),则填入的两种离子是,其中有气体生成的化学反应方程式可以为。

宏观辨识与微观探析是科学学科的重要核心素养。如图为某化学反应的微观模拟示意图,下列说法中,正确的是( )

A . 反应前后氧元素的化合价没有改变
B . 生成的丙、丁两物质的分子个数比为2:1
C . 该反应属于复分解反应
D . 参加反应的甲、乙两物质的质量比为13:16
下图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“一”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。

-
(1) A物质是 (填化学式)。
-
(2) C与E反应的基本类型是。
-
(3) 从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有(填序号)。
①2类 ②3类 ③4类 ④5类
向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示.下列说法正确的是( )

A . a点溶液中含有两种溶质
B . c点溶液中含有三种溶质
C . 根据图中数据不能计算出氢氧化钠溶液的浓度
D . d点溶液中主要存在的离子为Na+、SO42-
“登高取物”是科学学习中一种常见的游戏方式,游戏规则如下:梯子上下相邻的物质之间若能发生反应,游戏者可以上升一格,最终登顶者可以获得“足球”奖励。甲、乙同学根据规则从Na2SO4、CuSO4、HCl.BaCl2中选择合适物质填入①、②、③处,最终都顺利获奖。

-
(1) ③是。
-
(2) 写出图中发生的复分解反应方程式。(写一个即可)
某探究小组的同学用H2SO4、Na2CO3、NaOH、BaCl2四种溶液进行“复分解反应发生条件”及应用的实验探究:将四种溶液两两混合,若用H2SO4分别与另三种Na2CO3、NaOH、BaCl2溶液分别混合:
-
(1) 实验中,能直接观察到说明H2SO4与Na2CO3溶液发生化学反应的证据是:
-
(2) 实验中的H2SO4与NaOH混合“无明显现象”,但实际上发生了化学反应,其反应的实质是H+ 和OH— 结合生成H2O。同理,H2SO4与BaCl2发生了化学反应,其反应的实质是 。
由此同学们总结得出:复分解反应发生的条件是有沉淀或气体或水生成。
某化工厂有甲、乙两个车间,排出的污水澄清透明,经分析分别含有三种不同的离子,两厂废水中共有 Ba2+、K+、Cu2+、OH-、NO3-、CO32-六种离子
-
(1) 甲车间的废水含有 3 种离子,明显呈碱性,则乙车间排放的污水中所含有的 3 种离子是(填离子符号)
-
(2) 将甲、乙两车间的废水按适当的比例混合,可以变废为宝,既能使废水中的 Ba2+、Cu2+、OH-、CO32-等离子转化为沉淀除去,又可用上层清液来浇灌农田, 清液中含的溶质主要是(填化学式).
下列各组物质能大量共存且形成无色透明溶液的是( )
A . Na2CO3、KCl、KNO3
B . K2SO4、BaCl2、HCl
C . FeSO4、HCl、KCl
D . HNO3、KOH、NaCl
下列化学方程式客观存在且属于复分解反应类型的是( )
A . CO+CuO 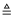 CO2+Cu
B . Fe+ H2SO4=FeSO4+H2↑
C . KCl+NaNO3=KNO3+NaCl
D . CaCO3+2HCl= CaCl2 +CO2↑+H2O
CO2+Cu
B . Fe+ H2SO4=FeSO4+H2↑
C . KCl+NaNO3=KNO3+NaCl
D . CaCO3+2HCl= CaCl2 +CO2↑+H2O
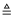 CO2+Cu
B . Fe+ H2SO4=FeSO4+H2↑
C . KCl+NaNO3=KNO3+NaCl
D . CaCO3+2HCl= CaCl2 +CO2↑+H2O
CO2+Cu
B . Fe+ H2SO4=FeSO4+H2↑
C . KCl+NaNO3=KNO3+NaCl
D . CaCO3+2HCl= CaCl2 +CO2↑+H2O
为防治酸雨,可将造纸厂回收的碱白泥(主要成分是碳酸钙和氢氧化钠)掺进煤中进行“固硫”。在该过程中不可能发生的化学反应有( )
A . CaCO3  CaO+CO2↑
B . 2NaOH+SO2=Na2SO3+H2O
C . CaO+SO2
CaO+CO2↑
B . 2NaOH+SO2=Na2SO3+H2O
C . CaO+SO2  CaSO3
D . CaCO3+2NaOH=Ca(OH)2+Na2CO3
CaSO3
D . CaCO3+2NaOH=Ca(OH)2+Na2CO3
 CaO+CO2↑
B . 2NaOH+SO2=Na2SO3+H2O
C . CaO+SO2
CaO+CO2↑
B . 2NaOH+SO2=Na2SO3+H2O
C . CaO+SO2  CaSO3
D . CaCO3+2NaOH=Ca(OH)2+Na2CO3
CaSO3
D . CaCO3+2NaOH=Ca(OH)2+Na2CO3
用如示装置模拟废液(含硫酸铜、硫酸镁及一些不溶物)净化实验,步骤如下:

Ⅰ.往沉降槽中加入适量凝絮剂明矾,加速沉降
Ⅱ.往反应槽中缓慢加入一定浓度的NaOH溶液,至沉淀完全
Ⅲ.通过盛装有活性炭的水槽后,调节溶液的pH=7,储存在指定容器中
-
(1) 测得原废液pH=5,显(选填“酸性”、“碱性”或“中性”)
-
(2) 反应槽中生成蓝色沉淀的化学方程式为,该反应属于基木反应类型中的反应。
为鉴别氯化钠、氢氧化钠、碳酸钠和硫酸钠四种物质的溶液,设计如下实验:

下面对试剂@、试剂②和试剂③的选择,合理的是( )
A . ①酚酞②稀盐酸③氯化钡
B . ①酚酞②稀盐酸③稀盐酸
C . ①石蕊②氯化钡③稀盐酸
D . ①石蕊②氯化钡③碳酸钠
下列说法符合图中漫画情景的是( )

A . 此反应可能是复分解反应
B . 若金属1是锌,金属2可能是铁
C . 此反应可能是Cu+2AgCl=2Ag+CuCl2
D . 此反应可表示CuSO4与NaOH溶液反应
建立模型是学习科学的重要方法,下列建立的科学模型中正确的是( )
A .  杠杆的分类模型
B .
杠杆的分类模型
B .  物质酸碱度模型
C .
物质酸碱度模型
C .  物质的分类模型
D .
物质的分类模型
D .  化合反应与复分解反应的关系模型
化合反应与复分解反应的关系模型
 杠杆的分类模型
B .
杠杆的分类模型
B .  物质酸碱度模型
C .
物质酸碱度模型
C .  物质的分类模型
D .
物质的分类模型
D .  化合反应与复分解反应的关系模型
化合反应与复分解反应的关系模型
下列对反应X+3NaOH=3Y+Fe(OH)3↓的分析,错误的是( )
A . X中含有三价元素
B . X可能是Fe2(SO4)3
C . Y中一定含有Na元素
D . Y可能是NaNO3
CaCl2溶液和NaHCO3溶液反应生成CaCO3沉淀。为表示这个反应写出了下列甲、乙两个反应方程式:
甲:CaCl2+NaHCO3=CaCO3↓+NaCl+HCl
乙:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O
我认为反应化学方程式不合理,理由是。
最近更新



