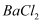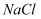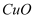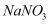化合物之间的相互转化 知识点题库
下列物质的转化关系均能一步实现的是( )

有关CuSO4制备途径及性质如图所示.
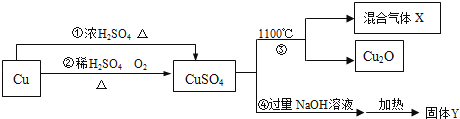
已知:
①Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O.
CuSO4+SO2↑+2H2O.
②在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.下列说法不正确的是( )
选项 | 化学反应方程式 | 反应类型 | 气体性质 |
A | Fe+H2SO4=FeSO4+H2↑ | 置换反应 | 还原性 |
B | 2H2O2=2H2O+O2↑ | 分解反应 | 可燃性 |
C | 2KClO3=2KCl+3O2↑ | 化合反应 | 氧化性 |
D | CaCO3+2HCl=CaCl2+H2O+CO2↑ | 复分解反应 | 酸性 |
-
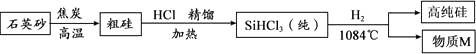
(1) 三氯硅烷(SiHCl3)是由种元素组成的物质。
-
(2) 在H2和SiHCl3反应的过程中若混入O2 , 可能引起的后果是。
-
(3) 以上生产高纯硅的流程中,可循环使用的物质是。
 Ca(OH)2溶液
Ca(OH)2溶液  NaOH溶液
B . Fe
NaOH溶液
B . Fe  Fe2O3
Fe2O3  Fe2(SO4)3溶液
C . Cu
Fe2(SO4)3溶液
C . Cu  Cu(NO3)2溶液
Cu(NO3)2溶液  Cu(OH)2
D . C
Cu(OH)2
D . C  CO
CO  CO2
CO2  Na2CO3溶液
Na2CO3溶液

【提出问题】未观察到浑浊的原因是什么?
-
(1) 【猜想和假设】
①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。
经讨论,同学们认为猜想①不合理,其理由是。
-
(2) 【进行实验】乙组同学针对猜想②进行实验。
实验目的
实验操作
实验现象
探究猜想②
取4支试管,向其中分别加入……
碳酸钠溶液浓度/%
是否浑浊
10
不浑浊
5
不浑浊
1
浑浊
0.5
浑浊
【解释与结论】
a.补全上述实验操作:取4支试管,向其中分别加入。
b.乙组实验证明:猜想②不成立,碳酸钠溶液浓度在0.5%至10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是。
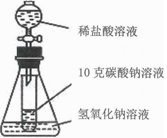
-
(1) 小明在碳酸钠溶液中先滴加无色酚酞作为指示剂,然后再逐滴滴加稀盐酸。
①当观察到说明稀盐酸和碳酸钠刚好完全反应。
②当恰好完全反应时,消耗溶质质量分数为7.3%的稀盐酸10克,计算该碳酸钠溶液的溶质质量分数。
-
(2) 小红直接往试管中滴加一定量的稀盐酸,反应结束后,锥形瓶中溶液增加a克。小红将a克当作生成二氧化碳质量并计算碳酸钠溶液中溶质的质量分数,发现计算结果比小明要偏小,请分析其可能的原因。 (写出两点)
混合气体中肯定存在的有 ;不能肯定的有。
选项 | 物质 | 用途 | 反应方程式 | 反应类型 |
A | 过氧化氢 | 制氧气 | H2O2=H2↑+O2↑ | 分解反应 |
B | 稀硫酸 | 制氢气 | 2Fe+3H2SO4=Fe(SO4)3+3H2 | 复分解反应 |
C | 生石灰 | 干燥剂 | CaO+H2O=Ca(OH)2 | 化合反应 |
D | 一氧化碳 | 冶炼金属 | CO+CuO | 置换反应 |
甲+  乙+
乙+  丙
丙 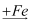 丁
丁  甲
甲
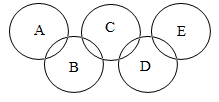
-
(1) B物质是。
-
(2) A与B的反应的实验现象是。
-
(3) 写出B与C反应的化学方程式。
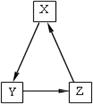
| | A | B | C | D |
| X | | | | |
| Y | | | | |
| Z | | | | |

-
(1) 上述流程中可循环利用的物质是。
-
(2) 甲醇(CH3OH)燃烧除了生成二氧化碳外,还生成一种常温下为液态的化合物,写出反应的化学方程式:。
-
(3) 证明燃烧产物中含有二氧化碳的方法是(用化学方程式表示)。
请回答下列问题:
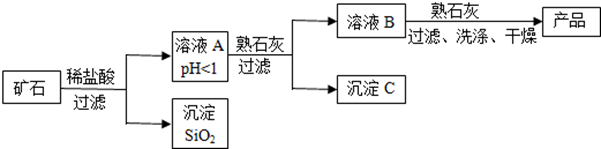
| 气氧化物 | Fe(OH)3 | cu(OH)2 | Mg (OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
-
(1) 溶液A中共含有种阳离子;
-
(2) 在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀,该实验条件下,使金属阳离子沉淀的相关pH数据见表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可允许的范围为是;
-
(3) 溶液B中一定含有的溶质为(填化学式).
-
(1) 二氧化硅的化学性质极稳定,氢氟酸(HF)是唯一可以与之发生反应的酸(生成物为H2O和SiF4气体),该反应的化学方程式为。
-
(2) 二氧化硅与碳酸钙在高温下反应生成硅酸钙(CaSiO3)和二氧化碳.其中硅酸钙在物质分类上属于(选填序号)。
①单质 ②氧化物 ③酸 ④碱 ⑤盐
 Cu+CO2
Cu+CO2