影响化学反应速率的因素探究 知识点题库
. 如下图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,不能观察到气球变大的一组物质是 
为了比较铝与相同pH的稀盐酸和稀硫酸反应的快慢,某化学兴趣小组做了如下的探究实验:

-
(1) 铝与稀硫酸反应的化学方程式为.
-
(2) x=,实验过程中,可以通过观察来比较铝与稀盐酸和稀硫酸反应的剧烈程度.
-
(3) 实验过程中,发现铝与稀盐酸反应更加剧烈,同学们提出了以下猜想:
猜想一:试管Ⅰ中氯离子对反应起了促进作用;
猜想二:试管Ⅱ中硫酸根离子对反应起了阻碍作用;
猜想三:以上两种猜想同时成立.
为了验证上述猜想是否正确,向试管Ⅰ中加入少量(填序号),向试管Ⅱ中加入少量(填序号),作对比试验.
A、硫酸铜 B、氯化钠 C、硫酸钠 D、浓盐酸
-
(4) 通过(3)中的对比试验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则猜想成立.
示例:在块状和粉末状石灰石中分别加入等质量、等质量分数的稀盐酸,前者反应较慢,后者反应较快.说明:当其他条件一定时,反应物的接触面积越大,化学反应速率越快.
(1)过氧化氢溶液在常温下只能缓慢分解出少量氧气,若向其中加入一些二氧化锰,则能够迅速分解,产生大量的氧气.
(2)碳在空气中燃烧发出红光,在氧气中可以剧烈燃烧,发出白光.
(假设9.125%、18.25%的稀盐酸的密度均为1g•cm﹣3;大理石中杂质不与盐酸反应)
-
(1) 写出上述实验中的化学方程式.
-
(2) 提出假设:稀盐酸与大理石反应的剧烈程度与所用稀盐酸的质量分数、大理石粗细、反应温度有关.
实验设计与实施:完成以下实验设计方案并实验.
实验序号
T/℃
大理石规格
稀盐酸的
质量分数
完全反映的时间/s
实验目的
1
25
粗颗粒
18.25%
160
a.实验①和②探究同体积下稀盐酸质量分数对该反应剧烈成都的影响
b.实验①和③探究温度对该反应剧烈成都的影响
c.实验①和④探究大理石规格对该反应剧烈成都的影响
2
210
3
35
粗颗粒
18.25%
60
4
100
-
(3) 写出实验结论.
编号 | A | B | C | D |
实验设计 |
|
|
|
|
实验结论 | 二氧化碳能溶于水 | 化学反应前后物质的总质量不变 | 水是由氢气和氧气组成 | MnO2能加快H2O2反应速率 |
-
(1) 关于探究燃烧条件的实验
①2013年12月广州建业大厦发生严重火灾.从燃烧条件分析。大厦内存放的大量鞋、纸箱等物品充当了.高层建筑同城设计了灭火的洒水系统.从灭火原理分析,洒水的作用主要是.
②分析表中的数据,回答问题:

物质代号
L
M
N
P
熔点/℃
-117
3550
660
-259
沸点/℃
78
4827
2519
-253
着火点/℃
510
370
550
580
有人认为“物质的熔、沸点越高,着火点越高”,该结论——(填“合理”或“不合理”).已知酒精灯火焰的温度约为500。C.利用如图装置,为验证温度达到可燃物着火点是燃烧条件之一,表中可用于完成该实验的两种可燃物是和(填代号);
-
(2) 关于探究催化剂作用的实验:氯酸钾分解除了用二氧化锰外,还可以氧化铜等物质作催化剂.
【提出问题】氧化铜是否比二氧化锰的催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】以生成等体积的氧气为标准,设计了下列几组实验(其他可能影响实验的因素均忽略).
实验序号
KClO3的质量
其他物质的质量
温度
氧气的体积
反应所需时间
一
2.0g
/
330oC
100mL
t1
二
2.0 g
CuO 0.5g
330oC
100mL
t2
三
2.0g
MnO2 0.5g
330℃
100mL
t3
四
2.0g
MnO2………..g
380℃
100mL
t4
①若t1t2(填“大于”“等于”“小于”),说明氧化铜能加快氯酸钾的分解速率.
②你认为设计实验三和实验二对比的目的是:
③写出实验二中所涉及的化学方程式为;
④将实验三和实验四对比,可得出化学反应快慢与温度的关系,那么实验四中控制MnO2的质量应为g;若t3>t4 , 则化学反应快慢与温度的关系是
|
|
|
|
第一组 | 第二组 | 第三组 | 第四组 |

(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类.
(实验记录)同学们进行6组实验,实验记录如表:
| 实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
| 过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
| 水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
| 锥形瓶中的物质 | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | 0.5gNaCl | 0.5gFeCl3 |
| 60min内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
-
(1) 实验②中应加入过氧化氢溶液的体积x是mL.
-
(2) 实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定来比较过氧化氢的分解速率.
-
(3) 得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是(填序号).
-
(4) 通过实验①、②、④可得出的结论是.
-
(5) (反思与评价)
同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是(答两点).
-
(6) 某同学改用如图2所示装置代替气囊完成实验②,正确的实验操作顺序是.
a.将导管伸入量筒,开启控温加热器,滴入过氧化氢溶液
b.开启控温加热器,将导管伸入量筒,滴入过氧化氢溶液
c.开启控温加热器,滴入过氧化氢溶液,待导管口有连续均匀气泡冒出时将导管伸入量筒.
|
实验编号 |
氯酸钾的质量 |
其他物质的质量∕g |
温度∕℃ |
收集氧气的体积/mL |
反应所需时间∕s |
|
① |
2.0 |
330 |
100 |
t1 |
|
|
② |
2.0 |
CuO0.5 |
330 |
100 |
t2 |
|
③ |
2.0 |
MnO20.5 |
330 |
100 |
t3 |
|
④ |
2.0 |
MnO2____ |
_______ |
100 |
t4 |
请回答
-
(1) 进行实验②和③,并对对比,其实验目的是。
-
(2) 要说明氧化铜对氯酸钾分解速率的影响,则要选用实验和实验进行对比。
-
(3) 用实验③和④探究温度对氯酸钾分解速率的影响,则MnO2的质量是g,反应的温度是℃,实验④发生反应的化学方程式为;若t3>t4 , 氯酸钾分解速率与温度的关系是。
|
实验 序号 |
过氧化氢 溶液浓度/% |
过氧化氢 溶液体积/mL |
温度 /℃ |
二氧化锰 的用量/g |
收集氧气 的体积/m L |
反应所需 的时间/s |
|
① |
5 |
1 |
20 |
0. 1 |
4 |
16. 75 |
|
② |
15 |
1 |
20 |
0. 1 |
4 |
6. 04 |
|
③ |
30 |
5 |
35 |
2 |
49. 21 |
|
|
④ |
30 |
5 |
55 |
2 |
10. 76 |
-
(1) 通过实验①和②对比可知,化学反应速率与有关;从实验③和④对比可知,化学反应速率与温度的关系是;
-
(2) 用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,则产生氧气的总重量将(选填“减小、不变或增大”)。
-
(3) 写出实验②中反应的文字表达式:。
|
实验序号 |
| | 温度 | 二氧化锰的用量 | 收集氧气的体积 | 反应所需的时间 |
| | 5 | 1 | 20 | | 4 | |
| | 15 | 1 | 20 | | 4 | |
| | 30 | 5 | 35 | ______ | 2 | |
| | 30 | 5 | 55 | ______ | 2 | |
-
(1) 写出实验
 中反应的文字表达式。
中反应的文字表达式。
-
(2) 通过实验
 和
和  对比可知,化学反应速率与有关;从实验
对比可知,化学反应速率与有关;从实验  和
和 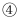 对比可知,化学反应速率与温度的关系是
对比可知,化学反应速率与温度的关系是  。
。
-
(3) 化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的碰撞概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是。
-
(4) 用一定量
 的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量
的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量  选填“减小”或“不变”或“增大”
选填“减小”或“不变”或“增大”  。
。
-
(1) 探究二氧化碳与水的反应
方案一
方案二(数字化实验)
Ⅰ、图1中可观察到甲试管中的紫色液体变为红色,乙试管的作用是。
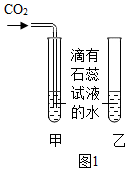
II、由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变(填“强”或“弱”),化学方程式为。
-
(2) 探究蜡烛燃烧的产物
方案一
方案二(数字化实验)
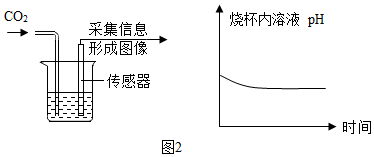
Ⅰ、如图3所示,用注射器在蜡烛外焰部位抽气并振荡,可观察到,该反应生成了二氧化碳,该反应的化学方程式为。
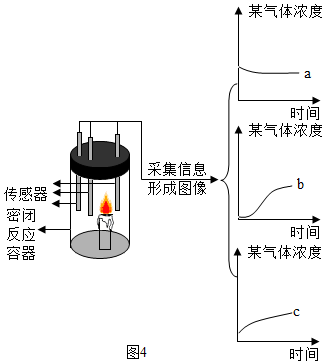
II、如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示。曲线。(选填“a”,“b”,“c”) 能够说明蜡烛燃烧生成了二氧化碳和水。
-
(3) 比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度
方案一
方案二(数字化实验)
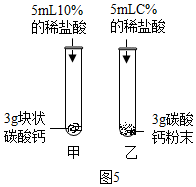
Ⅰ、图5中,乙试管中稀盐酸的浓度C%应为,发生反应的化学方程式为。
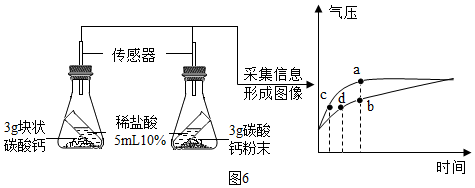
Ⅱ、按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示。对比分析坐标图中的点(选填a~d)可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与粉末与稀盐酸反应所需时间更短。
-
(1) (认识铁的腐蚀)
下列环境中的铁制品最容易生锈的是_______(填字母序号)。
A . 未擦干的铁锅 B . 除油漆的栏杆 C . 盛水的不锈钢水杯 -
(2) 铁锈的主要成分是Fe2O3·xH2O,其中铁元素的化合价是。
-
(3) (探究铁的腐蚀)
该小组用下图甲装置进行实验,起始时量筒内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约(填“40”或“10”)mL刻度处,原因是。

-
(4) (拓展探究)
小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按上图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。
温度/℃
10
20
30
40
50
60
70
铁钉质量增加/g
0.02
0.04
0.08
0.16
0.18
0.18
0.18
小强同学的实验是探究因素对铁钉腐蚀快慢的影响,结论是。
-
(5) 有同学认为小强的实验未能真实反映50℃以后铁钉腐蚀的快慢,理由是50℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:;改进实验方案证明你的分析:。
|
实验序号 |
过氧化氢溶液浓度/% |
过氧化氢溶液质量/g |
温度/℃ |
二氧化锰用量/g |
氧气体积/ml |
反应所需时间/s |
|
① |
5 |
12 |
20 |
0.2 |
125 |
11 |
|
② |
30 |
12 |
20 |
0.2 |
125 |
2 |
|
③ |
30 |
12 |
40 |
/ |
125 |
148 |
|
④ |
30 |
12 |
90 |
/ |
125 |
82 |
-
(1) 通过实验①和②对比可知,化学反应快慢与温度的关系是,
-
(2) 通过对比实验和可知,化学反应快慢与温度的关系是,
-
(3) 由上述实验可知,实验室用过氧化氢制取氧气的最合适的体积是,
-
(4) 为什么过氧化氢分解制氧气一开始反应很快,过一段时间后反应由很慢。
| | | | |
| A电解水 | B加热一定质量的高锰酸钾 | C相同质量的镁、铝分别与过量的等浓度的稀盐酸反应 | D等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应 |
| | | | |
| A.表示等质量等溶质质量分数的过氧化氢溶液分别在有、无MnO2的条件下反应 | B.表示等质量的碳酸钙粉末分别与足量的溶质质量分数为5%和10%的稀盐酸反应 | C.表示等质量的锌粉和铁粉分别与足量的等溶质质量分数的稀盐酸反应 | D.表示等质量的锌粉和锌粒分别与足量的等溶质质量分数的稀盐酸反应 |
-
(1) 反应物的接触面积会影响化学反应速率。向等质量的块状大理石和粉末状大理石中分别加入足量10%的盐酸,则下图中(填“A”或“B”)表示粉末状大理石的反应。

-
(2) 硫在氧气中比在空气中燃烧得更剧烈,其影响因素是什么?。







 溶液浓度
溶液浓度