物质的相互转化和制备 知识点题库
其流程如下:

(1)操作Ⅰ的名称是 ,该操作中需要用到玻璃棒,其作用是 .
(2)“沉淀”时需控制温度在0~2℃,比较简单易行的方法是将反应容器放置在 中,制备CaO2•8H2O时反应温度不宜过高,原因一是防止因温度过高导致氨水挥发,原因二是防止 .(用化学方程式表示)
(3)为检验“水洗”是否合格,可取最后一次洗涤液少量于试管中,再滴加 (填试剂),若无白色沉淀产生说明“水洗”合格.
(4)该流程中除水外可循环利用的物质是 (填化学式).
硅(Si)是太阳能电池和电脑芯片不可缺少的材料.利用石英砂(主要成分为SiO2)生产高纯硅(Si)的流程图如下(整个制备过程必须达到无水、无氧气).

(提示:Si+3HCl  SiHCl3+H2↑)
SiHCl3+H2↑)
根据以上信息判断,下列相关说法错误的是( )
 SiHCl3+H2↑反应中硅元素的化合价未发生改变
SiHCl3+H2↑反应中硅元素的化合价未发生改变
黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4 , 利用如图实验可制取补血剂原料碳酸亚铁并回收铜。

-
(1) 步骤Ⅰ中,发生反应的化学方程式包括:
①Fe2(SO4)3+Fe=3FeSO4;
②;
③。
-
(2) 步骤Ⅱ中加入一种试剂可实现其转化,该试剂可以是(填化学式)。
-
(3) 步骤Ⅲ回收铜的实验操作包括:①过滤、②洗涤、③加足量稀硫酸、④干燥,正确的操作排序是(填序号)。
-
(4) 若废铁屑含有少量铁锈,对实验结果(填“有”或“无”)影响。

则下列有关说法中,错误的是( )
 2KHCO3
B . 分解池发生的主要反应为2KHCO3═K2CO3+CO2↑+H2O
C . 由分解池分解后所得溶液X可通入吸收池再利用,其主要成分是KHCO3
D . 合成塔中发生反应的化学方程式为2H2+CO2
2KHCO3
B . 分解池发生的主要反应为2KHCO3═K2CO3+CO2↑+H2O
C . 由分解池分解后所得溶液X可通入吸收池再利用,其主要成分是KHCO3
D . 合成塔中发生反应的化学方程式为2H2+CO2  CH4O(甲醇)
CH4O(甲醇)

-
(1) X的化学式为.
-
(2) 反应②中空气的作用是.
-
(3) 石青的化学式为2CuCO3•Cu(OH)2 , 写出反应③的化学方程式.
-
(4) 若反应④中硫酸铜、生石灰和水的化学计量数之比为1:1:1,则其化学方程式为.

-
(1) 氯碱厂用电解饱和食盐水的方法制取烧碱,同时得到氯气和氢气.写出其化学方程式:.
-
(2) 钛冶炼厂氯化车间的氯化过程发生如下反应:2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO,则X的化学式为.已知FeTiO3中铁元素显+2价,则钛元素的化合价为.
-
(3) 试写出TiCl4与Mg反应生成金属Ti的化学方程式,该反应的基本反应类型是.上述反应需在氩气环境中进行,理由是.
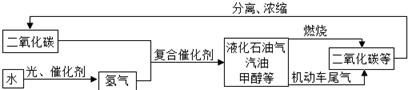
根据上述流程回答下列问题:
-
(1) 上述流程中可循环利用的物质是;
-
(2) “低碳”的含义是;
-
(3) 甲醇(CH3OH)燃烧除了生成二氧化碳外,还生成一种常温下为液态的化合物,写出反应的化学方程式。
-
(4) 证明燃烧产物中含有二氧化碳的方法是(用化学方程式表示)。

-
(1) 操作I的名称是,该操作中玻璃棒的作用是;
-
(2) 操作Ⅱ是根据KMnO4和K2CO3两种物质在溶解性上的差异将两者分离。具体操作步骤为:蒸发浓缩、降温结晶,过滤,洗涤干燥,得KMnO4晶体。则两者中(填化学式)的溶解度受温度影响变化更大,母液E是高锰酸钾的溶液(填“饱和”或“不饱和)过程中温度不宜过高,原因是(用方程式表示)。
-
(3) “通CO2”的反应化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2↓十2K2CO3 , 该反应中锰元素的转化率(所得高锰酸钾中锰元素与反应物中锰元素的质量百分比)为(精确到小数点后一位)。
-
(4) 电解法也可以实现由K2MnO4向KMnO4的转化,与“通CO2”相比,其优点是(填字母,该反应的化学方程式为:2K2MnO4+2H2O
 2KMnO4+2KOH十H2↑)。
2KMnO4+2KOH十H2↑)。 a.节约能源
b.锰元素转化率高
c.得到的KOH可以循环利用
d.可以同时获得氢气

-
(1) 写出下列物质的化学式:A;D;F;
-
(2) R在反应①中起作用;
-
(3) 写出反应③的文字表达式;该反应所属的化学基本反应类型是。
-
(1) Ⅰ、黄铜是铜和锌的合金,某化学兴趣小组为研究合金中的铜的含量,取样品15g进行如下操作。

操作①的名称是。该操作用到的玻璃仪器有玻璃棒、烧杯、。
-
(2) 加入稀硫酸发生的反应的化学方程式为。
-
(3) 最后称得黄色固体为13g,得到含铜量为86.7%,高于实际含铜量,其原因可能是。

-
(1) 图中标示的材料中,属于有机合成材料的是。
-
(2) 飞机机身大量使用铝合金。铝合金具有的优点有:密度小、抗腐蚀性强,硬度比纯铝。
-
(3) 钛(Ti)和钛合金被认为是21世纪重要的金属材料。以金红石(主要成分是TiO2)为原料生产钛的步骤有:
①在高温下,向金红石与焦炭的混合物中通入Cl2 , 得到TiCl4和一种可燃性气体;
②在稀有气体环境和加热条件下,用Mg和TiCl4反应得到Ti和MgCl2。其中步骤①中的化学方程式为 。

-
(1) 过滤器和集中处理器中分离提纯的气体是。
-
(2) 反应器中搅拌的目的是。
-
(3) 反应器中反应的符号表达式为。
-
(4) 反应器中另一种处理方法是利用钉(Ru)作催化剂将CO2在高温条件下转化为甲醇(CH3OH)。反应的微观模型如下图所示。

①反应的符号表达式为:;
②下列关于该反应前后的说法中正确的是(填序号)。
A 分子的种类不变 B 原子的种类不变 C 物质的种类不变 D 元素化合价都不变

已知:SiO2难溶于水和常见的酸:“沉镁”过程中有Mg(OH)2生成。
-
(1) 酸浸时,为提高矿石的浸出率,可采取的措施为(催化剂除外)
-
(2) 滤渣X的主要成分为(填化学式)。
-
(3) 实验室中用图1所示装置进行过滤。
①该装置中仪器A的名称为。
②若过滤时滤液出现浑浊,可能的原因是(填字母)。
a滤纸已破损 b漏斗中液面低于滤纸边缘c滤纸未紧贴漏斗内壁
-
(4) 沉镁时MgSO4与NH3•H2O发生反应。结合图2,写出该反应的化学方程式。
-
(5) 已知在不同温度下,充分加热等质量的Mg(OH)2 , 加热温度与固体残留率的关系如图3所示。加热时温度至少要达到350℃,原因是。

 B .
B .  C .
C .  D .
D . 


【查阅资料】常温下氢氧化物开始沉淀与沉淀完全时的pH如下表:
pH | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 1.1 | 2.8 |
Mg(OH)2 | 8.4 | 10.9 |
-
(1) 为了提高“酸浸”的效果,可采取的措施有。
-
(2) 滤液1中的溶质为(写化学式)。
-
(3) 向滤液1中通入Cl2后,滤液中的二价铁全部转化为三价铁,再加入NaOH溶液时应控制溶液的pH范围为。
-
(4) 写出Mg(OH)2加热得到产物MgO的化学方程式。
-
(5) 若原菱镁矿的质量为50g,实验结束后测得MgO的质量为20g,则原菱镁矿样品中镁元素的质量分数为(不考虑流程中镁的损耗)。

已知:加热条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
-
(1) 步骤①产生的废气B中,定含有的有害气体是(填化学式)。环保处理最好采用的试剂是(填字母序号)。
A.浓硫酸 B.食盐水 C.石灰乳
-
(2) 写出步骤④中得到铜的化学方程式,它属于基本反应类型中的反应。

已知:不同温度下,硫酸钾在水溶液、氨溶液中的溶解度:
温度(℃) | 0 | 10 | 25 |
水溶液 | 6.815 | 8.496 | 9.937 |
氨(8%)溶液 | 1.387 | 1.558 | 2.198 |
氨(35%)溶液 | 0.442 | 0.742 | 0.813 |
-
(1) 在“脱硫”反应中,将CaCO3粉碎后与水混合成悬浊液的目的是。
-
(2) 脱硫过程的化学方程式为:
 。
。
-
(3) 石膏与饱和(NH4)2CO3溶液相混合发生反应Ⅰ,反应基本类型为。
-
(4) “操作I”的名称是。
-
(5) 你认为反应Ⅱ在常温下能实现的原因是。
-
(6) CaSO4·2H2O受热会逐步失去结晶水。取纯净CaSO4·2H2O固体3.44g,进行加热,测定固体质量随温度的变化情况如图所示。CaSO4·2H2O相对分子质量为172。

H点的固体在T2~1400℃范围内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,写出发生反应的化学方程式。

-
(1) 若甲、乙、丙依次是氢气、水、硫酸。乙→丙时所需另一种反应物中,一定含有氧元素和元素。
-
(2) 若甲是紫红色金属,丙的溶液呈蓝色。
①乙的化学式是。
②写出乙→丙的化学方程式:。
-
(3) 若甲、乙是两种常见的碱。
①丙的化学式是。
②写出乙→丙的化学方程式:。



