物质的相互转化和制备 知识点题库
下列物质间的转化,不能一步实现的是( )
A . NaOH → NaCl
B . CO2→ CaCO3
C . Fe → Fe(OH)3
D . CaO→ CaCl2
下列各组变化中,每个转化在一定条件下均能一步实现的是( )

A . ①②
B . ①③
C . ②③
D . ①②③
FeSO4•7H2O是一种重要的食品和饲料添加剂.某工业废渣主要成分是Fe2O3 , 还含有CaCO3和SiO2(既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO4•7H2O的流程如图1:

请根据流程图回答下列问题:
-
(1) 稀硫酸与粉末中的氧化铁反应的化学方程式为
-
(2) 操作②所需要的玻璃仪器是:烧杯、玻璃棒和.
-
(3) 经测定,滤渣中只含有CaSO4和SiO2 , 你认为实验室(填“能”或者“不能”)用粉末状的石灰石与稀硫酸反应制二氧化碳.
-
(4) Fe与Fe2(SO4)3反应的化学方程式为.
-
(5) 硫酸亚铁的溶解度曲线如图2.待结晶完毕后,滤出晶体,用少量冰水洗涤2﹣3次.用冰水洗涤的目的是:
Ⅰ除去晶体表面附着的杂质;
Ⅱ.

硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如图所示:

-
(1) 硫铁矿是物(填“纯净”或“混合”).
-
(2) 写出C与Fe3O4反应的化学方程式.
-
(3) 反应Ⅰ的反应温度一般需控制在35℃以下,其目的是.
-
(4) 产品a的主要成分是K2SO4 , 检验产品a中是否含有氯化物(Cl﹣)杂质的实验操作是:取少量产品a加水溶解,.
绿矾又名七水硫酸亚铁(FeSO4•7H2O),其用途广泛,可用于制铁盐、氧化铁颜料、净水剂、防腐剂、消毒剂等.绿矾(FeSO4•7H2O)的一种综合利用工艺如下:

-
(1) 隔绝空气进行“焙烧”,铁元素的转化途径是:(提示:该过程中所用的还原剂的是CO)
FeCO3
 FeO
FeO  Fe
Fe资料:【难溶性碳酸盐受热分解成金属氧化物、二氧化碳气体】
写出高温条件下进行“焙烧”过程中①②反应的化学方程式:
①②
-
(2) 粗产品(NH4)2SO4还可以作肥.
含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图1.

-
(1) 粉碎的目的是.
-
(2) 若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、和,此处玻璃棒的作用是.
-
(3) 物质X是,滤渣中含有的金属单质有,除铜时发生的反应属于反应(填基本反应类型)
-
(4) 流程中获得七水硫酸锌前省略的操作是、冷却结晶、、洗涤和低温烘干.
-
(5) 某温度下,Fe(OH)3分解得到一种铁、氧质量比21:8的氧化物,该氧化物的化学式.
-
(6) 除铁过程中,温度、pH对除铁效果的影响分别对如图2所示.由图2可知,除铁时温度应控制在℃为宜,pH应控制在.为宜.
氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。CuCl制备流程如图:
已知:CuCl难溶于水,在潮湿空气中易变质。

-
(1) “反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3 , Na2SO3中硫元素的化合价是,产生的SO3能迅速与水化合生成一种常见的酸,该反应的化学方程式为。
-
(2) “操作a”中的玻璃棒的作用是。若得到的滤液2有浑浊,原因可能是(写出一种即可)。
-
(3) 可用“水洗”的原因是。
-
(4) 本流程中可以循环利用的物质(水除外)是(填化学式)。
氧烛是一种便携式供氧设备(如下图)。产氧药块由氯酸钠(分解时吸收热量为QkJ·g-1)、金属粉末(燃烧时提供氯酸钠分解所需的热量)和少量催化剂组成。某兴趣小组拟自制氧烛,火帽为确定每100g氯酸钠需要添加金属粉末的质量[m(金属)],查得下表数据:


下列说法正确的是( )
A . m(金属)只能采用不同比例的金属和氯酸钠在空气中实验获得
B . m(金属)只能通过氯酸钠分解吸收热量与金属燃烧放出热量进行理论药块计算确定
C . m(金属)过小将使氧烛中反应无法持续进行,过大将减小产氧量
D . 不用催化剂时,分别使用铁、铝、镁作燃料,m(Fe)最小
A,B,C是初中化学常见的三种物质,均含有氢元素且所含元素种类依次递增。在常温下,A是一种无色气体,B是一种无色液体;A具有可燃性,C能使紫色的石蕊试液变红。(注:下列反应均为一步完成的化学反应,部分反应物或生成物未标出。)

-
(1) A的化学式为,构成A物质的微粒是(填名称)。
-
(2) B是,证明B中含有氢元素的方法是(用化学方程式表示)。
-
(3) C转化为B同时生成另外一种温室气体,检验该气体的原理是:(用化学方程式表示)。
甲.乙、两三种物质转化关系如图所示(“→”表示反应能一步实现,“一”表示相连物质能发生反应,部分反应物、生成物和反应条件均已略去),则不满足的是()

A . 甲是O2 , 丙是CO2
B . 甲是H2 , 乙是O2
C . 乙是NaOH,丙是Na2CO3
D . 甲是HNO3 , 丙是NaNO3
A,B,C,D,E,F是初中化学常见的物质,都含有一种相同的元素。其中B是常见的溶剂,D和F是组成元素相同的气体,E是铁锈的主要成分。它们的相互关系如图所示(图中“﹣”表示两端的物质间能发生反应,“→”表示物质间存在转化关系;部分反应物、生成物和反应条件已略去)。请回答。

-
(1) B的化学式是。
-
(2) 写出D的一种用途。
-
(3) E和F反应的化学方程式为。
-
(4) A→C化学反应的基本类型是反应。
某工厂的废水中含有MgSO4和FeCl3等,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。

资料:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Mg(OH)2 |
|
开始沉淀 |
1.9 |
9.1 |
|
完全沉淀 |
3.2 |
11.1 |
-
(1) 操作①的名称,该工厂废水一定呈性。
-
(2) 用NaOH溶液调节溶液的pH,pH的控制在范围内,可使废液中的铁离子(Fe3+)完全沉淀,而镁离子(Mg2+)又不损耗。
-
(3) 操作②时,当即可停止加热。
-
(4) 固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为。
-
(5) 溶液a除了可能含有NaOH外,还一定含有的溶质是(填化学式)。
-
(6) 配制2000kg质量分数为5%的氢氧化钠溶液,需要氢氧化钠Kg。
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A . O2  Fe3O4
Fe3O4  Fe
B . H2O2
Fe
B . H2O2  H2
H2  H2O
C . Ca(OH)2
H2O
C . Ca(OH)2  CaCO3
CaCO3 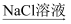 Na2CO3
D . CO2
Na2CO3
D . CO2  CO
CO 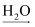 H2CO3
H2CO3
 Fe3O4
Fe3O4  Fe
B . H2O2
Fe
B . H2O2  H2
H2  H2O
C . Ca(OH)2
H2O
C . Ca(OH)2  CaCO3
CaCO3 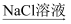 Na2CO3
D . CO2
Na2CO3
D . CO2  CO
CO 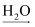 H2CO3
H2CO3
工业制备蔗糖的流程如图所示,请回答下列问题:

-
(1) 操作A的名称是。
-
(2) 糖汁呈棕黄色,工业上可加入吸附糖汁中的色素,对糖汁进行脱色处理。
-
(3) 关于工业制备蔗糖,下列说法正确的是。
A 蔗糖溶液是纯净物
B 由甘蔗制得蔗糖的整个过程中主要是物理变化
C 蔗渣常被用于发酵制备酒精或肥料,此过程属于剧烈氧化
D 在实验室中进行操作A时要用到玻璃棒,其作用是引流
利用黄铁矿(主要成分为FeS2)制备硫酸的主要工艺流程如下图所示:

-
(1) 黄铁矿粉碎的目的。
-
(2) 写出反应釜1中产生的Fe2O3的一种用途:。
-
(3) 反应釜2中反应前后化合价发生改变的元素有。
-
(4) 写出反应釜3中发生化合反应的化学方程式。
X、Y、Z是初中化学常见的三种物质,它们之间有如图所示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件均已略去)。下列选项不符合该转化关系的是( )

A . CO、C、CO2
B . NaCl、NaOH、Na2CO3
C . MgCl2、Mg、MgO
D . Ca(OH)2、CaCO3、CaCl2
下列物质间的转化关系能实现的是( )
A . CuO→CuSO4→Cu(OH)2→CuCO3
B . Fe→Fe2O3→FeCl2→Fe(OH)3
C . CaCO3→CaO→Ca(OH)2→CaCl2
D . KCl→KNO3→K2SO4→KOH
氯化钙在道路或者房屋施工(建筑行业)过程中,用作防冻剂、实验室作干燥剂、在食品行业用作豆制品的絮凝剂等。某工厂废渣主要成分是 CaCO3 , 还含有少量 C、Fe2O3、MgO 等杂质。化学兴趣小组废物利用,利用上述废渣制作 CaCl2 , 反应过程如图所示。

-
(1) Ⅰ过程中加过量稀盐酸溶液的目的是。
-
(2) Ⅰ过程中CaCO3发生反应的化学反应方程式。
-
(3) 滤渣一的成分为(填化学式);
-
(4) X溶液为(填化学式);
-
(5) 已知CaCl2与焦炭、BaSO4在高温下生成BaCl2和CO和CaS,写出该反应的方程式:。
从氯碱工业产生的盐泥中回收BaSO4 , 其主要工艺流程如下图。

已知:盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
-
(1) 酸溶槽中为什么不能用稀硫酸代替稀盐酸。
-
(2) 酸溶槽中发生的中和反应的化学方程式为。
-
(3) “2号槽”中的操作目的是。
-
(4) “溶液A”中的溶质是。
某黄铜矿渣中含有大量CuS及少量的铁和氧化铁,工业上以该矿渣为原料生产CuSO4·5H2O晶体的流程如图。

已知:CuS常温下不和稀酸发生反应;铁与硫酸铁反应生成硫酸亚铁。
-
(1) 操作I用到的玻璃仪器有玻璃棒、烧杯、,其中玻璃棒的作用是。
-
(2) 向黄铜矿渣中加入过量稀硫酸发生复分解反应的化学方程式为,所得滤液中一定含有的溶质的化学式为。
-
(3) 写出CuS与O2在高温条件下发生反应的化学方程式:。
-
(4) 固体E与物质D反应时需在加热条件下进行,加热的目的是。
-
(5) 操作II包括的步骤有、冷却结晶、过滤等。
-
(6) 上述过程中可循环使用的物质的化学式为。
最近更新



