物质的相互转化和制备 知识点题库
-
(1) 煅烧石灰石可制得活性CaO,反应的化学方程式为.为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示.可知:CaO与水反应会热量(填“放出”或“吸收”);上述温度中,℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是.
-
(2) 以电石渣[主要成分为Ca(OH)2 , 还含有少量MgO等杂质]为原料制备高纯CaCO3的流程如下:

①如图为NH4Cl浓度对钙、镁浸出率的影响(浸出率=
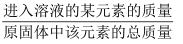 ×100%).可知:较适宜的NH4Cl溶液的质量分数为;浸取时主要反应的化学方程式为.
×100%).可知:较适宜的NH4Cl溶液的质量分数为;浸取时主要反应的化学方程式为.②流程中虚线内部分若改用溶液(填化学式),可一步得到与原流程完全相同的生成物.
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3 , 试从生物的角度分析原流程的优点:
a.NH3可循环利用;b..


-
(1) 二氧化硅的结构与金刚石相似,都是由原子构成的,二氧化硅属于(选填“化合物”或“单质”).
-
(2) 装有氢氧化钠(NaOH)溶液的试剂瓶不能用玻璃塞,原因是在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O.Na2SiO3使瓶口与瓶塞粘合在一起,则该反应的化学方程式为:
.
-
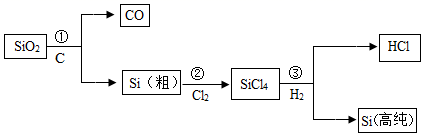
(3) 硅是太阳能电池和电脑芯片不可缺少的材料.生产高纯硅的流程示意图如下:

①制备粗硅的反应为:SiO2+2C
 Si+2CO↑其中有还原性的物质是.
Si+2CO↑其中有还原性的物质是.②整个制备过程必须达到无水无氧,若在H2还原SiHCl3过程中混入O2 , 可能引起的后果是.
③为了达到绿色化学和节约资源的目的,物质A需要循环使用,A的化学式是.

-
(1) 反应①和反应③都要进行的操作是;
-
(2) 反应②中发生反应的化学方程式为;
-
(3) 反应③中用NaOH溶液控制pH的目的是.

-
(1) 一、过氧化钙的性质研究
取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试
管中,观察到带火星的木条,说明过氧化钙与水反应有氧气生成。
-
(2) 分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成。
结论:过氧化钙和水反应生成氢氧化钙和氧气。
-
(3) 二、过氧化钙的制备研究
实验室用钙盐制备CaO2 , 其主要实验装置(图1)和流程(图2)如下:

图1试管中的物质是NH4Cl和Ca(OH)2 , 加热时发生反应生成CaCl2、NH3 和H2O,
反应的化学方程式为。
-
(4) “沉淀”时发生的反应为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,需要控制温度在0℃左右,采用的操作是将反应容器放置在中,反应温度不能过高的原因是:①防止氨水挥发;②。
-
(5) “过滤”所得的副产品NH4Cl可做化肥中的肥。检验“水洗”已经洗净的方法是:取最后一次洗涤液少量于试管中,。
-
(6) 加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2
 2CaO+O2↑)。
2CaO+O2↑)。右图是实验室测定产品中CaO2纯度的装置。实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算。(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程)。


若样品质量用wg表示,反应前称量药品和小试管总质量为mg,反应后在空气中冷却,称量药品和小试管总质量为ng,则CaO2纯度
 ,此方案测定结果偏小的原因可能是。
,此方案测定结果偏小的原因可能是。

-
(1) (A类)常温下,下列各组物质中,甲既能与乙反应又能与丙反应的是( )
甲
乙
丙
A
Fe2O3
CO
稀盐酸
B
H2
Cl2
CuO
C
Ba(NO3)2溶液
稀硫酸
NaOH溶液
D
CO2
Ca(OH)2溶液
H2O
A . A B . B C . C D . D -
(2) (B类)常温下,下列各组物质中,甲乙之间、乙丙之间可以相互转化的是( )
甲
乙
丙
A
CO
CO2
CaCO3
B
H2O2
O2
SO2
C
Fe3O4
Fe
FeSO4
D
H2CO3
H2O
Ca(OH)2
A . A B . B C . C D . D -
(3) (C类)下列各组物质中,存在如图所示的相互反应和一步转化关系的是( )
甲 乙 丙 A H2SO4 CO2 Ca(OH)2 B HCl MgCl2 Cu C CaO CaCO3 Ca(OH) 2 D SO3 H2O NaOH A . A B . B C . C D . D

①固体物质的成分有哪些?
②写出乙与硝酸钡反应的化学方程式?
③操作I和操作Ⅱ中都要用到一种玻璃仪器。该仪器在操作Ⅱ中的作用是什么?

 Al2O3+H2
Al2O3+H2
 2CuSO4+2H2O。
2CuSO4+2H2O。

回答下列问题。
-
(1) 操作①中,使用的玻璃仪器除烧杯/玻璃棒外,还需;
-
(2) 滤渣③中含有的金属是;
-
(3) 根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是NiFe(填“>”或“<”)。
-
(4) 滤液③中加入足量铁粉的主要目的是,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为;
-
(5) 相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是。

已知:SiO2不与盐酸反应

-
(1) 设备Ⅰ中发生反应的化学方程式为。
-
(2) 设备Ⅲ中参加反应的物质除水外,还有。
已知:Mg能与N2 , CO2等气体反应。

-
(1) 钛(Ti)被称为“未来金属”。以钛铁矿(主要成分为钛酸亚铁FeTiO3)为原料冶炼金属钛,一种生产工艺流程如上图2。
①FeTiO3中钛的化合价为。
②反应Ⅰ还生成一种可燃性无色气体,该反应的化学方程式为。
③反应Ⅱ在中进行。(填字母)
A 稀有气体 B 空气 C N2 D CO2
-
(2) 铝被称为“年轻的金属”。
①铝有“自我保护”的作用,原因是表面生成一层致密的氧化膜,该氧化膜的化学式为。
②人类冶炼和使用铝的时间较晚,可能是因为(填字母)。
A 地壳中铝元素含量少 B 冶炼铝的技术要求高
③原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原子构成,其最外层电子数的总和为40时相对稳定。一个铝原子最外层有3个电子,则该稳定铝原子簇的微粒符号为。
④硅酸铝玻璃常用于制作手机屏幕,据此推断其可能具有的性质是(填字母)。
A 透光性好 B 易溶于水 C 见光易分解 D 常温下不与O2反应
-
(3) 锂(Li)被称为“绿色能源金属”。
①某电池放电时反应:
 ,能量转化形式为(填“电能→化学能”或“化学能→电能”)。电池级碳酸锂(Li2CO3)生产反应之一为氯化锂(LiCl)溶液与碳酸钠溶液发生复分解反应,该反应的化学方程式为。
,能量转化形式为(填“电能→化学能”或“化学能→电能”)。电池级碳酸锂(Li2CO3)生产反应之一为氯化锂(LiCl)溶液与碳酸钠溶液发生复分解反应,该反应的化学方程式为。②图3为某款锂电池手机在不同温度下的电压随待机时间变化图像。当电压低于3.0V,手机会自动关机。请分析手机电池在冬天不耐用的原因可能是(填字母)。

A 温度越低,电压下降到3.0V时,时间越短
B 温度越低,会降低锂电池的化学反应速率,导致存储电量变小

-
(1) 操作I的名称是。
-
(2) 反应②的化学方程式为。
-
(3) 从上述化工流程中看出可以循环使用的物质是(填化学式)。
-
(1) 硅是太阳能电池和电脑芯片必需材料。工业上利用石英砂(主要含SiO2)制得高纯硅,其生产工艺流程如下图所示:

①步骤Ⅰ中制备粗硅的反应为


 , 该反应属于反应。(填“分解”、“化合”、“置换”或“复分解”之一)
, 该反应属于反应。(填“分解”、“化合”、“置换”或“复分解”之一)②硅与碳的化学性质相似,从原子结构角度分析,其主要原因是(填序号之一)。
A.质子数相同 B.电子层数相同 C.最外层电子数相同 D.中子数相同
③写出步骤Ⅲ中发生反应的化学方程式。
③步骤Ⅲ必须在无氧、无水环境中进行,若混入氧气,则可能产生的后果是。
-
(2) 我国化学家侯德榜创立了侯氏制碱法,以海水“晒盐”得到的氯化钠为原料,最终制得Na2CO3和NH4Cl产品,两者的溶解度曲线如图所示。试回答:

①t1℃时,NH4Cl饱和溶液的溶质质量分数Na2CO3饱和溶液的溶质质量分数(填“大于”、“小于”或“等于”之一)。
②若使某NH4Cl不饱和溶液转化为饱和溶液,下列方法中不可行 的是(填序号之一)。
A.加NH4Cl固体 B.降低温度 C.加适量水 D.恒温蒸发
③t1℃时,一小试管内盛有Na2CO3饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛水的烧杯中(如图所示),向烧杯的水中加入某固体物质X,发现试管内的Na2CO3固体 逐渐溶解。根据所学知识推断,所加物质X可能是,(选填“NaOH”、“NaCl”或“NH4NO3”之一)请结合溶解度曲线分析,小试管内固体物质逐渐溶解的原因是。




