合成氨条件的选择 知识点
合成氨条件的选择 知识点题库
 2NH3 , 是工业上制造氮肥的重要反应.下列关于该反应的说法正确的是( )
2NH3 , 是工业上制造氮肥的重要反应.下列关于该反应的说法正确的是( )(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式
②图A中氨气的体积分数为15.00%时,H2的转化率=
③图B中T=500℃,温度为450℃对应的曲线是 (选填字母“a“或“b”),选择的理由是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是 (写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O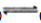 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
|
时间/min |
CH4(mol) |
H20( mol) |
CO (mol) |
H2 (mol) |
|
0 |
0.40 |
1.00 |
0 |
0 |
|
5 |
X1 |
X2 |
X3 |
0.60 |
|
7 |
Y1 |
Y2 |
0.20 |
Y3 |
|
10 |
0.21 |
0.81 |
0.19 |
0.62 |
①分析表中数据,判断5〜7min之间反应是否处于平衡状态 (填“是”或“否”),
前5min平均反应速率v(CH4)=
②反应在7~10min之间,CO的物质的量减少的原因可能是 (填字母).
a·减少CH4 b·降低温度c·增大压强d·充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O. mol CO、 mol H2 , 达到平衡时CH4的体积百分含量与第一次投料相同.

-
(1) X的化学式为;X的状态为态.
-
(2) 据图分析,下列说法正确的是(填写编号).
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
-
(3) 常温下氨气极易溶于水,其水溶液可以导电.
①氨水中水的离子积常数的数值是;
②将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为.
 2NH3 , 回答下列问题:
2NH3 , 回答下列问题:
-
(1) 反应过程中拆开的化学键是;
-
(2) 反应放热,从价键角度分析,反应放热的原因是,下列图像正确的是。
-
(3) 在体积是2L的密闭容器中开始加入1molN2 , 3molH2 , 反应过程浓度中,物质的浓度与时间的关系如图所示。
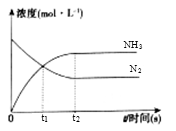
①t1时生成NH3的物质的量是;用H2表示的化学反应速率υ(H2)=。
②下列各项能表明反应达到化学平衡状态的是。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH-H键同时形成6molN-H键
-
(4) 下列措施中能提高合成氨反应化学反应速率的是。
A.使用高效催化剂
B.恒温恒容再充入氢气
C.降低反应温度
D.扩大容器体积
-
(1) 为了提高农作物的产量,德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺,请用化学方程式表示工业合成氨的反应原理;为什么选择20~50Mpa的高压?说明理由。
-
(2) 氨气通入水中可制得氨水,氨水能使无色的酚酞变红,请用电离方程式表示其原因:。
-
(1) 制硫酸的三种原料是、、,三个生产过程是①,写出反应方程式,②,写出反应方程式,③,写出反应方程式,三废指的是、、。
-
(2) 合成氨的反应原理工业合成氨的反应条件为浓度使用过量的、温度℃、高压MPa、。
 2NH3(g),该反应一定条件下自发。下列有关说法正确的是( )
2NH3(g),该反应一定条件下自发。下列有关说法正确的是( )

 溶液加水稀释至V L,pH随lg V的变化
B . 图乙表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度
溶液加水稀释至V L,pH随lg V的变化
B . 图乙表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度 C . 图丙表示一定条件下的合成氨反应中,NH3平衡体积分数随H2始体积分数(N2起始量恒定)的变化,图中a点N2转化率小于b点
D . 图丁表示同一温度下,在不同容积的容器中进行反应
C . 图丙表示一定条件下的合成氨反应中,NH3平衡体积分数随H2始体积分数(N2起始量恒定)的变化,图中a点N2转化率小于b点
D . 图丁表示同一温度下,在不同容积的容器中进行反应
 , O2的平衡浓度与容器容积的关系
, O2的平衡浓度与容器容积的关系

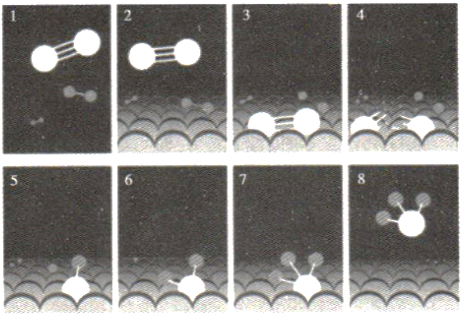
 键
C . NH3分子中的N—H键不是同时形成的
D . Fe催化剂可以有效提高反应物的平衡转化率
键
C . NH3分子中的N—H键不是同时形成的
D . Fe催化剂可以有效提高反应物的平衡转化率
 2NH3(g)ΔH= -92.4 kJ·mol-1的说法正确的是( )
2NH3(g)ΔH= -92.4 kJ·mol-1的说法正确的是( )
 的值可增大N2的转化率
D . 可以使用酶作该反应的催化剂
的值可增大N2的转化率
D . 可以使用酶作该反应的催化剂
 2NH3(g) △H<0,则下列说法错误的是( )
2NH3(g) △H<0,则下列说法错误的是( )



