合成氨条件的选择 知识点题库
①4NH3 (g)+5O2 (g)⇌4NO (g)+6H2O (g)△H=﹣9072kJ•mol﹣1 K=1.1×1026
②4NH3 (g)+4O2 (g)⇌2N2O (g)+6H2O (g)△H=﹣1104.9kJ•mol﹣1 K=4,.4×1028
③4NH3 (g)+3O2 (g)⇌2N2 (g)+6H2O (g)△H=﹣1269.02kJ•mol﹣1 K=7,.1×1034
其中,②、③是副反应.若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
①提高合成氨的速率 ②提高氢气的转化率③提高氨的产率 ④催化剂在700K时活性最大.
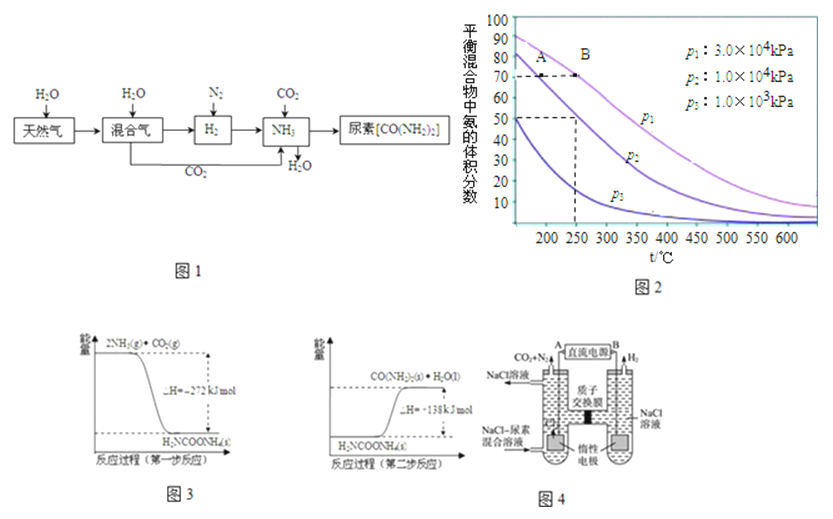
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学化学方程式为
(2)图2为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数.
①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”).
②在相同温度、当压强由p1变为p3时,合成氨反应的化学平衡常数 (填“变大”、“变小”或“不变”).
(3)NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图3如下:NH3(g)与CO2(g)反应生成尿素的热化学方程式为 人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图4所示.阳极室中发生的反应依次为
(4)运输氨时,不能使用铜及其合金制造的管道阀门.因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+ , 该反应的离子方程式为
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨.
 2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。 
-
(1) 表示N2浓度变化的曲线是 (填字母),25 min 时c (NH3)=。
-
(2) 0~25min内,用H2 浓度变化表示的化学反应速率是。
-
(3) 此温度下,上述反应的平衡常数K 的数值为。
-
(4) 若升高温度,则平衡向(填“正反应”或“逆反应”)方向移动;正反应速率 (填“增大”“减小”或“不变”,下同 ), 逆反应速率。

 2Li3N
D . 该工艺的总反应为N2+3H2
2Li3N
D . 该工艺的总反应为N2+3H2  2NH3
2NH3
 氧化为
氧化为  时需使用催化剂,这样是为了提高
时需使用催化剂,这样是为了提高  的转化率
D . 用氨水吸收硫酸的尾气,目的是保护环境且能够得到化肥
的转化率
D . 用氨水吸收硫酸的尾气,目的是保护环境且能够得到化肥
 , 一般采用770K左右的温度,其原因是( )
, 一般采用770K左右的温度,其原因是( )①提高 的转化率 ②适当提高氨的合成速率
的转化率 ②适当提高氨的合成速率
③提高氨的产率 ④催化剂在700K左右时活性最大
 和
和 混合气体有利于合成氨
B . 高压比常压更有利于合成氨的反应
C . 500℃左右比室温更有利于合成氨的反应
D . 合成氨时采用循环操作,可提高原料的利用率
混合气体有利于合成氨
B . 高压比常压更有利于合成氨的反应
C . 500℃左右比室温更有利于合成氨的反应
D . 合成氨时采用循环操作,可提高原料的利用率
 C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )

 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
 时刻,
时刻,  的浓度分别是
的浓度分别是 则时间间隔
则时间间隔 内,
内,  生成的平均速率为
生成的平均速率为
Ⅰ.主反应:
Ⅱ.副反应:
-
(1) 已知:Ⅲ.

Ⅳ.

则

-
(2) CO2加氢合成甲烷时,通常控制温度为
 左右,其可能的原因为____
A . 反应速率快 B . 平衡转化率高 C . 催化剂活性高 D . 主反应催化剂选择性好
左右,其可能的原因为____
A . 反应速率快 B . 平衡转化率高 C . 催化剂活性高 D . 主反应催化剂选择性好 -
(3)
 时,向1L恒容密闭容器中充入
时,向1L恒容密闭容器中充入 和
和 , 初始压强为p,
, 初始压强为p, 时主、副反应都达到平衡状态,测得
时主、副反应都达到平衡状态,测得 , 体系压强为
, 体系压强为 , 则
, 则 内
内 ,平衡时
,平衡时 选择性=(
选择性=( 选择性
选择性 , 计算保留三位有效数字)
, 计算保留三位有效数字)
-
(4) 以
 催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为
催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为 。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式
。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能
 。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是。
。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是。



