制备实验方案的设计 知识点题库
已知:①5Fe2++MnO  +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO  +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
-
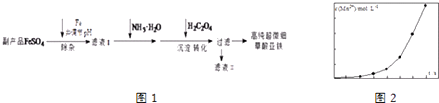
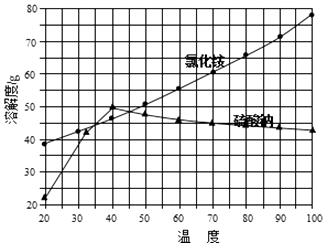
(1) 沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有.
-
(2) 滤液Ⅱ经处理可得到副产品.
-
(3) 实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2mol•L﹣1的H2SO4溶解.
步骤2:用0.2000mol•L﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2mol•L﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为.
-
(4) 将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为
试填写下列空白:
-
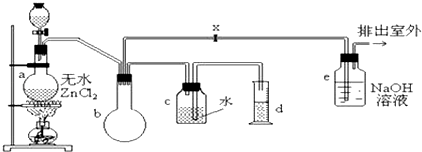
(1) 制备一氯甲烷的化学方程式,其反应类型属于反应;
-
(2) 装置b的作用是;
-
(3) 已知卤代烃能发生碱性水解,转化为醇.装置e中可能发生的反应方程为;.
-
(4) 检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(燃烧产物中含氯产物只有HCl).则CH3Cl燃烧的化学方程式是;
-
(5) 实验中实际按甲醇和浓盐酸1:2(物质量之比)进行反应的理由是;
-
(6) 某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是.
【查阅资料】
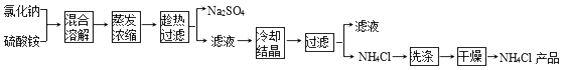
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl 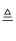 NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示:
请回答下列问题:
-
(1) 写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式:.
-
(2) 欲制备10.7g NH4Cl,理论上需NaCl质量为g.
-
(3) 实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有.
-
(4) “冷却结晶”过程中,析出NH4Cl晶体的合适温度为.
-
(5) 不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤
现象
结论
取少量氯化铵产品于试管底部,
表明氯化铵产品纯净

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
-
(1) 步骤I中所用的试剂是。
-
(2) 步骤III中反应的离子方程式是。
-
(3) 步骤V可选用的试剂是(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
-
(4) 步骤VI的实验操作是。
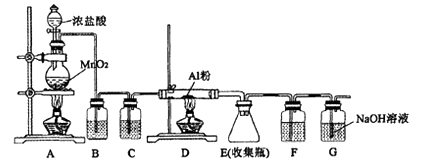
I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4 向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62- )。
步骤5....
步骤6 数据处理,计算黑灰中BaS含量。
-
(1) 步骤2实验中所需的玻璃仪器有烧杯、漏斗.500mL容量瓶、。
-
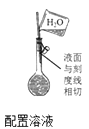
(2) 步骤4到达滴定终点时,滴定管中液面如图所示,此时滴定管读数为 mL。若盛装Na2S2O3标准溶液的滴定管未润洗,则所测得的 BaS含量将会 (填“偏高”、“偏低"或“ 不变” )。

-
(3) 为保证实验结果的准确性,步骤5应为。
-
(4) II.氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。
酸性矿井水( 主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为。
-
(5) 查阅资料发现铁元素的存在对SO2含量(mg/L)的测定结果影响较大。请补充完整测定酸性矿井水中SO42-含量的实验步骤:量取一定体积的酸性矿井水,,根据采集的数据计算废水中SO42-含量。
(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/L BaCl2溶液)
 B .
B .  C .
C .  D .
D . 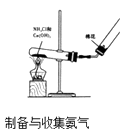
| 选项 | 物质及其杂质 | 检验方法 | 除杂 |
| A | Cl2(HCl) | 通入AgNO3溶液中 | 饱和食盐水 |
| B | FeCl2溶液(FeCl3) | 滴入KSCN溶液 | 通入过量氯气 |
| C | 乙酸乙酯(乙酸) | 滴入NaHCO3溶液 | KOH溶液 |
| D | KNO3晶体(NaCl) | 焰色反应 | 重结晶 |

已知:氢化钙遇水剧烈反应。下列说法正确的是( )

已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:
-
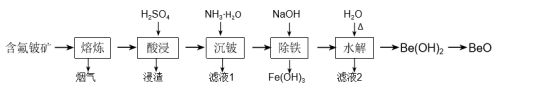
(1) “熔炼”的温度为1600℃,其中约20%的Al2O3反应生成烟气(主要成分为AlF3),该反应的化学方程式为。
-
(2) 浸渣的主要成分为CaSO4、。
-
(3) 加入氨水中和酸浸液,若将pH调至8~9,“沉铍”时产生的沉淀物主要有:、、。
-
(4) “沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,铍元素参与反应的离子方程式为,然后加适量水稀释进行“水解”,目的是。
-
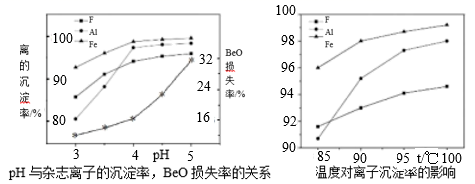
(5) 若为高氟铍矿,需在“沉铍”前进行“除氟”。工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。根据如图实验数据,选择的实验条件为pH=,水浴加热温度T=℃。
-
(6) 氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:。

-
(1) MgCO3与稀硫酸反应的化学方程式为。
-
(2) 加入H2O2氧化时,发生反应的离子方程式为。
-
(3) 滤渣2的成分是(填化学式)。
-
(4) 煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgSO4+C
 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑MgSO4+3C
 MgO+S↑+3CO↑
MgO+S↑+3CO↑利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是(填化学式)。
②C中溶液用于吸收CO2 , B中盛放的溶液可以是(填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:。

已知:①过滤后的浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
-
(1) 浸出过程中Co2O3发生反应的离子反应方程式为。
-
(2) NaClO3在浸出液中的作用。
-
(3) 加入Na2CO3调pH至5.2,目的是;萃取剂层含锰元素,则沉淀II的主要成分为MgF2和。
-
(4) 操作I包括:、、过滤、洗涤、减压烘干等过程。
-
(5) 为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是(回答一条原因即可)。
-
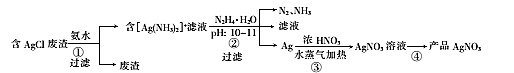
(1) 步骤①用氨水浸取时,温度不宜超过35℃,其原因是 。在氨水浓度、固液质量比和温度均一定时,为提高银的浸取率还可采取的措施是;浸取时发生反应的离子方程式为。
-
(2) 步骤②中发生反应的离子方程式为。
-
(3) 步骤③中,银与浓硝酸反应生成等物质的量的NO和NO2 , 当消耗了10.8g Ag时,有molHNO3参与了反应。
-
(4) 步骤④的操作为,100℃下烘干得产品AgNO3。
-
(5) 上述流程中发生了氧化还原反应的步骤有(用“①”“②”“③”“④”填空)。
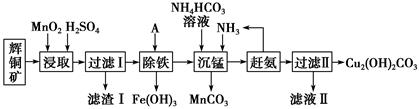
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
-
(1) 加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有(任写一种)。
-
(2) 滤渣I中的主要成分是MnO2、S、SiO2 , 请写出“浸取”反应中生成S的化学方程式:。
-
(3) 常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为mol/L。
-
(4) 写出“沉锰”(除 Mn2+)过程中反应的离子方程式:。
-
(5) “赶氨”时,最适宜的操作方法是。
-
(6) 滤液Ⅱ经蒸发结晶得到的盐主要是(写化学式)。
-
(7) 过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是。
 和
和 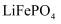 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 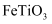 ,还含有少量MgO、
,还含有少量MgO、  等杂质)来制备。工艺流程如下;
等杂质)来制备。工艺流程如下; 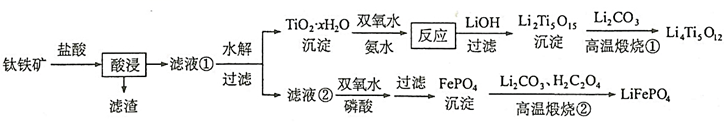 回答下列问题:
回答下列问题:
-
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件为。

-
(2) “酸浸”后,钛主要以
 形式存在,写出相应反应的离子方程式。
形式存在,写出相应反应的离子方程式。
-
(3)
 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示: 温度/℃
30
35
40
45
50
 转化率/%
转化率/%92
95
97
93
88
分析40℃时
 转化率最高的原因。
转化率最高的原因。 -
(4) 若“滤液②”中
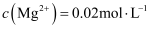 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使  恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 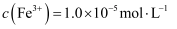 ,此时是否有
,此时是否有  沉淀生成?(列式计算说明理由)[已知
沉淀生成?(列式计算说明理由)[已知 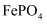 、
、  的
的  分别为
分别为  、
、 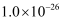 ].
].
-
(5) 写出“高温煅烧②”中由
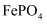 制备
制备 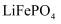 的化学方程式。
的化学方程式。
-
(6) 一种钛酸锂二次电池原理如图,放电时
 由N极层状材料中脱出经由电解质嵌入M极层状材料中,充电时N极电极反应方程式为,放电时M极每增重7g,负载中转移电子数为。
由N极层状材料中脱出经由电解质嵌入M极层状材料中,充电时N极电极反应方程式为,放电时M极每增重7g,负载中转移电子数为。 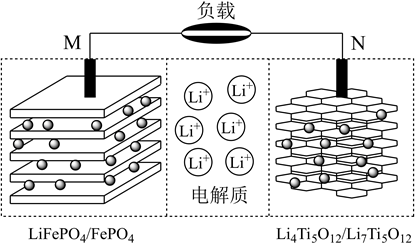
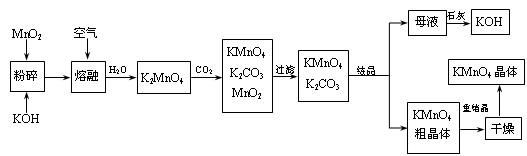
-
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。A . 75%酒精 B . 双氧水 C . 苯酚 D . 84消毒液(NaClO溶液)
-
(2) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
。
-
(3) 向K2MnO4溶液中通入CO2以制备KMnO4 , 该反应中的还原剂是:。
-
(4) 上述流程中可以循环使用的物质有石灰、二氧化碳、和(写化学式)。
-
(5) 若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得mol KMnO4。
 )用于制备光导纤维和有机硼化物等,制备原理:
)用于制备光导纤维和有机硼化物等,制备原理: 。某小组据此设计实验制备
。某小组据此设计实验制备 并测定其纯度,装置如图:
并测定其纯度,装置如图: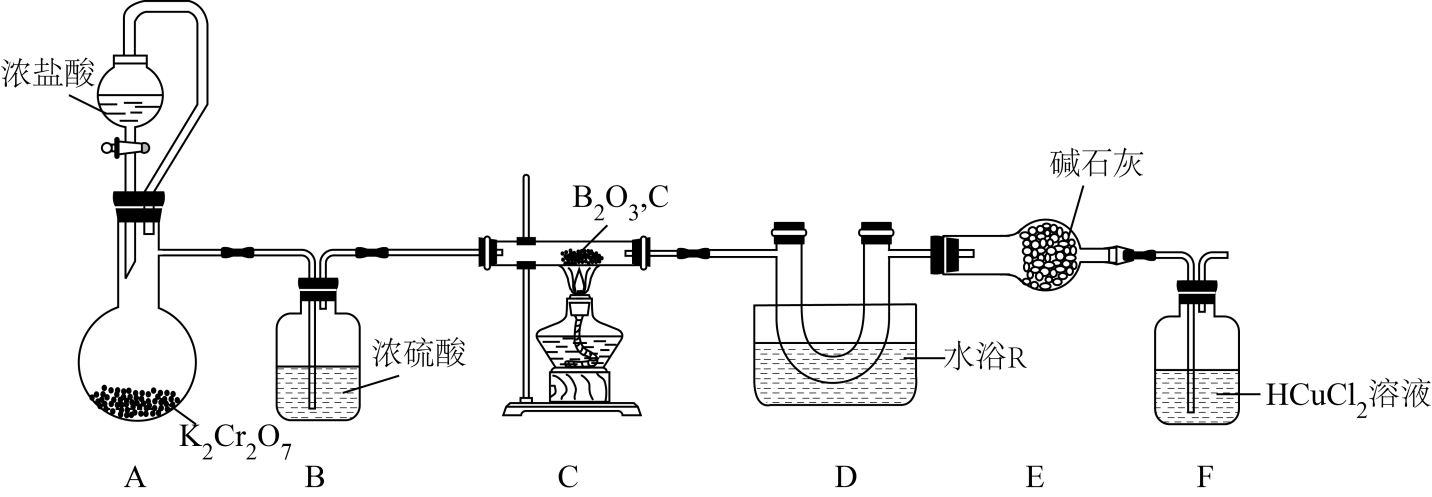
已知 的熔点为-107.3℃,沸点为12.5℃,极易水解产生
的熔点为-107.3℃,沸点为12.5℃,极易水解产生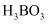 [或
[或 ]和HCl。
]和HCl。
-
(1) 实验(一):制备
 。
。水浴R选择(填“热水浴”或“冰水浴”),装碱石灰的仪器是(填名称)。
-
(2) F装置的作用是。
-
(3) 已知:A装置中还原产物为
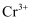 , 其离子方程式为。
, 其离子方程式为。
-
(4) 实验(二):探究
 的性质。
的性质。据文献资料显示,
 在乙醇中剧烈反应生成硼酸酯和“白雾”,与
在乙醇中剧烈反应生成硼酸酯和“白雾”,与 在水中发生水解相似。
在水中发生水解相似。写出三氯化硼与乙醇反应的化学方程式:。
-
(5) 实验(三):测定
 产品的纯度。
产品的纯度。①准确称取wg产品,置于蒸馏水中,完全水解,并配成250mL溶液。
②准确量取25.00mL溶液于锥形瓶中。
③向其中加入
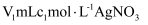 液至沉淀完全,然后加入3mL硝基苯(常温常压下,密度为
液至沉淀完全,然后加入3mL硝基苯(常温常压下,密度为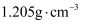 ),振荡。
),振荡。④向锥形瓶中滴加3滴
 溶液,然后逐滴加入
溶液,然后逐滴加入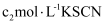 标准溶液滴定过量的
标准溶液滴定过量的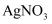 溶液,消耗KSCN溶液的体积为
溶液,消耗KSCN溶液的体积为 mL。已知:
mL。已知: 。
。步骤③加入硝基苯的目的是;滴定终点时的现象是。
-
(6) 该产品中
 的质量分数为%;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,测得产品中
的质量分数为%;如果其他操作都正确,仅滴定管没有用KSCN溶液润洗,测得产品中 的质量分数(“偏高”、“偏低”或“无影响”)。
的质量分数(“偏高”、“偏低”或“无影响”)。
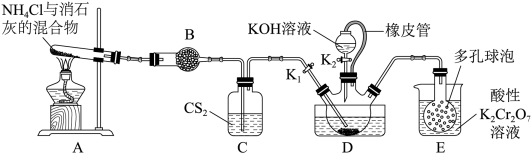
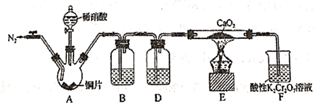
已知:①CS2不溶于水,密度比水大;②三颈烧瓶内盛放有CS2、水和催化剂。
-
(1) 制备NH4SCN溶液:
①实验前,经检验装置的气密性良好。装置A中发生反应的化学方程式为;装置B中的试剂是。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是。
②实验开始时,打开K1 , 加热装置A、D,使A中产生的气体级级通入D中,发生反应:
CS2+3NH3
 NH4SCN+NH4HS,该反应缓慢进行至CS2消失。
NH4SCN+NH4HS,该反应缓慢进行至CS2消失。 -
(2) 制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1和K2 , 移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS
 H2S↑+NH3↑),打开K2 , 继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为。
H2S↑+NH3↑),打开K2 , 继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为。②装置E中,NH3被酸性重铬酸钾氧化为氨气,反应的离子方程式为。
-
(3) 测定晶体史KSCN的含量:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),判断达到滴定终点的现象是。
②晶体中KSCN的质量分数为。



