验证质量守恒定律 知识点题库
(1)小云从电视新闻中了解到:国家新版《生活饮用水卫生标准》已从今年7月1日起强制实施,其中饮用水消毒剂除了目前采用的液氯以外,补充了——氯胺(NH2Cl)、臭氧(O3)。
①O3中氧元素的化合价是 。
②NH2Cl由 (填数字)种元素组成,其中氮元素与氢元素的质量比是 。
③NH2Cl用消毒时,发生反应NH2Cl+X=NH3+HClO,其中X的化学式是 。
(2)小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| Ⅰ | 1.2g | ||
| Ⅱ | 1.2g | CuO 0.5g | |
| Ⅲ | 1.2g | MnO2 0.5g |
①上述实验应测量的“待测数据”是 。
②若实验Ⅱ比实验Ⅰ的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
③将实验Ⅱ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到0.5g黑色粉末,再将黑色粉末放入试管中, 。(简述操作和现象)
【预期结论】氧化铜还能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验Ⅲ和实验Ⅱ对比的目的是 。
(3)小雪用如下图所示装置制取氧气的相关数据如下表。回答有关问题:
| 气体发生装置内物质的总质量 | |
| 反应前 | 35.6g |
| 反应后 | 34.8g |
①反应生成氧气的质量为 g(结果精确到0. 1 g,下同)。
②计算参加反应的过氧化氢的质量,写出必要的计算过程。 。
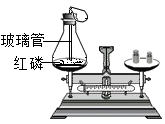
(1)反应中观察到的现象是;
(2)左盘锥形瓶口在白磷点燃后要塞紧瓶塞,原因是 ;
(3)在实验设计上,玻璃管上方系一瘪气球的目的是 .
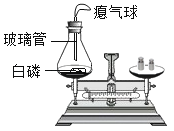

-
(1) 实验开始时,将气球中的大理石倒入锥形瓶中,观察到的现象是,天平的指针.(填“偏左”、“偏右”或“在标尺中央”,下同).
-
(2) 待上述实验的反应完成后,将锥形瓶瓶口上的单孔塞、导管和气球去掉,天平的指针;原因是

请根据示意图回答下列问题:
-
(1) 在上述反应中,分子分解成原子,(填“分子”“原子”之一)重新组合成新的分子。
-
(2) 上述反应的产物C、D中,与CO组成元素相同的是(填序号),属于氧化物的是。
-
(3) 写出上述反应的化学方程式:。

-
(1) 根据实验目的,小明应该测量的数据是(填“只有反应前”只有反应后”“反应前、后”之一)整个反应装置(包括锥形瓶、气球和药品)的质量。
-
(2) 实验步骤如下:
①按如图方式放好仪器,使天平平衡,记录称量数据;
②将碳酸钙粉末全部倒入锥形瓶中,观察到锥形瓶中液体里出现的现象之一是,发生反应的化学方程式是;
③当反应结束时,气球已经完全鼓起,小明发现天平的指针已经向右偏了。小明又重新称量,记录了数据。他感到困惑:其他操作均正常,实验现象与数据为何与预测结果不符?你认为出现该实验现象的合理解释最应该是下列各项中的(填序号)。
A.该反应前后原子的种类、数目变少
B.该反应生成物的总质量小于反应物的总质量
C.空气的浮力作用干扰了实验结果
D.生成气体的反应不遵守质量守恒定律
 探究水对铁生锈有无影响
B .
探究水对铁生锈有无影响
B .  探究质量守恒定律
C .
探究质量守恒定律
C .  探究铝、铜、银的金属活动性顺序
D .
探究铝、铜、银的金属活动性顺序
D . 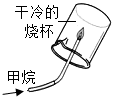 探究甲烷的组成
探究甲烷的组成
 验证质量守恒定律
B .
验证质量守恒定律
B .  测定空气中氧气含量
C .
测定空气中氧气含量
C .  探究铁钉锈蚀的条件
D .
探究铁钉锈蚀的条件
D .  探究燃烧条件之一:温度达到着火点
探究燃烧条件之一:温度达到着火点
-
(1) 初中化学有许多实验,若按照实验方法分类,可将实验(填字母)分为一类;分类的依据是 。

A 测定空气中氧气的含量
B 探究可燃物燃烧
的条件
C 探究反应前后物质的质量关系
D 探究铁钉生锈的条件
-
(2) 观察所给物质中氮元素化合价的排列规律,将合适的物质化学式填入空白处:N2、N2O、、N2O3、NO2。
-
(3) 类比金属单质间的置换反应,某些非金属单质间也能发生置换反应,如 Cl2 比 Br2(溴)活泼,能与 HBr 发生反应:Cl2+2HBr=2HCl + Br2。已知 Cl2比 N2活泼,则 Cl2 与NH3 在一定条件下发生反应的化学方程式为。
-
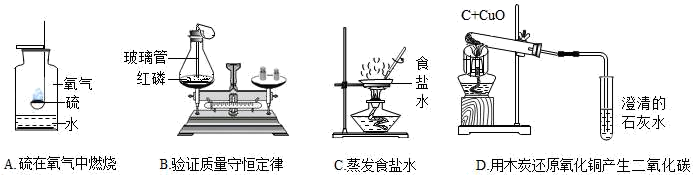
(1) A实验中集气瓶内水的作用是。
-
(2) B实验中玻璃管的作用是。
-
(3) C实验过程中,当蒸发皿中出现时,停止加热。用提纯的精盐配制100g 7.5%的生理盐水,若溶质质量分数偏小,其原因可能有。
①氯化钠固体不纯
②用量筒量取水时操作有误,如取水时俯视读数
③烧杯中有水
④称量时精盐和砝码放反了
⑤装瓶时,有少量溶液洒出
-
(4) D实验中酒精灯加网罩的作用。

-
(1) 实验一的目的是利用浓氨水的碱性和挥发性,验证;
-
(2) 实验二中,证明呼出的气体比空气中氧气含量少的操作是向两瓶中分别;
-
(3) 实验三中,通过测定盐酸和碳酸钠粉末反应前后的质量来验证质量守恒定律,前后两次称量结果不一致,原因是没有称量的质量。
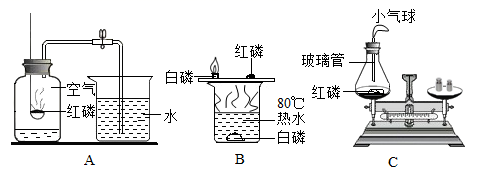
-
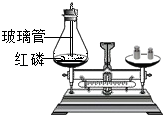
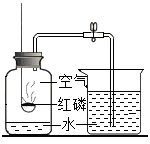
(1) 写出磷燃烧的化学方程式;
-
(2) 图A中红磷需稍过量的原因是;
-
(3) 图B中水的作用有加热和;
-
(4) 图C中玻璃管的作用是和防止实验过程中由于气体受热膨胀而冲开瓶塞。
 B . 探究燃烧的条件
B . 探究燃烧的条件  C . 验证质量守恒定律
C . 验证质量守恒定律  D . 比较黄铜和铜的硬度
D . 比较黄铜和铜的硬度 
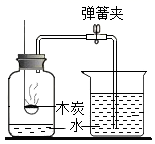
-
(1) 发生反应时观察到的现象是:。
-
(2) 反应前称得药品及仪器的总质量为148g,充分反应后称得液体药品及仪器的总质量为143.6g,此反应遵守质量守恒定律吗?如何改进装置让反应前后天平都平衡?
-
(3) 利用(2)的数据计算烧杯中碳酸钙粉末的质量(写出具体计算过程)。


-
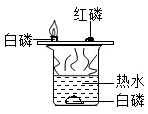
(1) 请写出镁条燃烧的化学方程式:。
-
(2) 同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是。
-
(3) 小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2。
(实验探究)
实验操作
实验现象
实验结论
取少量黄色固体于试管中,加入适量水,把放在试管口
黄色固体是Mg3N2
-
(4) (反思与交流)写出氮气和镁反应的化学方程式:,通过对该反应分析,你对燃烧条件的新认识:。
(实验方案)
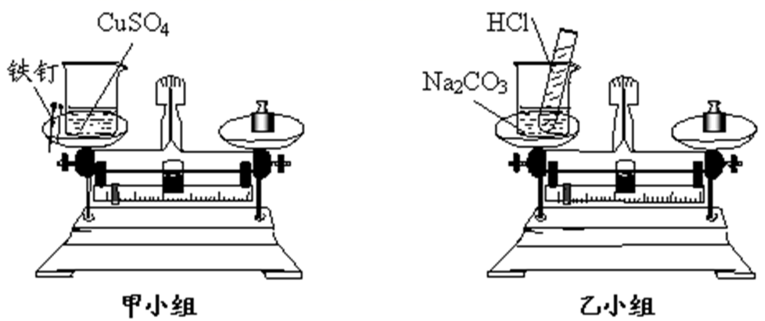
-
(1) (实验现象)反应后,甲小组的天平指针指向刻度盘的,乙小组的天平指针指向刻度盘的(选填“左边”、“右边”或“中间”)。
-
(2) (解释与结论)
甲小组的结论为:,
乙小组的解释为:。
-
(3) (反思与评价)比较两个小组的实验设计,若乙小组使用的试剂不变但要得到和甲小组相同的结论,你认为应对实验方案进行怎样的改进?。
-
(1) 在实际的生活生产中,化学制氧剂很多,如氯酸钠(NaClO3),氯酸钠中氯元素化合价为。可通过反应
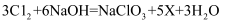 制取,X的化学式为。
制取,X的化学式为。
-
(2) 渔业养殖中,过碳酸钠(2Na2CO3·3H2O2)是一种白色粉末,能有效增氧和杀菌,分解会生成碳酸钠和过氧化氢。过碳酸钠属于(选填“混合物”或“纯净物”),过氧化氢在催化剂的作用下反应的化学方程式为。
-
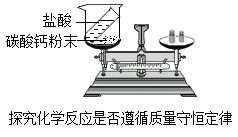
(3) 过碳酸钠分解产生的碳酸钠用于验证质量守恒定律,如图所示,该实验(选填“遵守”或“不遵守”)质量守恒定律;若要达到实验目的,在不改变药品的前提下,实验装置的改进方法是。

 测定空气中氧气的含量
B .
测定空气中氧气的含量
B .  探究甲烷中是否含碳元素
C .
探究甲烷中是否含碳元素
C .  验证质量守恒定律
D .
验证质量守恒定律
D .  配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液

-
(1) A是验证质量守恒定律的实验,实验过程中红磷的用量,对实验结果(填“有”或“无”)影响,实验中气球的作用是。
-
(2) B实验中玻璃棒的作用是。
-
(3) C是验证可燃物燃烧条件实验,烧杯内蜡烛燃烧一会儿就熄灭了,而空气中的蜡烛持续燃烧,说明可燃物燃烧的条件之一是。



