验证质量守恒定律 知识点题库

【实验步骤】如图所示,甲、乙两组同学分别把盛有适量NaOH、H2O2溶液的小试管放入盛有CuSO4溶液、MnO2溶液的烧杯中,并将烧杯放到天平上调至平衡,接着取下烧杯并将其倾斜,使物质混合发生反应,待反应后再把烧杯放到天平上,观察天平是否平衡,丙组同学取一根打磨干净的细铁丝和一个石棉网,将它们一起放在托盘天平上,用砝码平衡,取下铁丝,将铁丝放在充满氧气的集气瓶中点燃,燃烧结束并冷却后将所得的物质与石棉网一起再放回托盘天平上称量.
-
(1) 【实验分析】
请你仿照示例,完成实验现象的记录和分析.
实验现象
化学方程式
结论
甲组
产生蓝色沉淀,天平①(填“平衡”或“不平衡”)
②
该反应遵守质量守恒定律
乙组
烧杯中产生大量气泡,天平不平衡
③
该反应不遵守质量守恒定律
丙组
④,反应前后称量质量不相等
3Fe+2O2
 Fe3O4
Fe3O4该实验遵守质量守恒定律
-
(2) 通过对上述实验的对比分析,甲丙两组同学发现乙同学的结论是正确的,但结论却是错误的.在实验操作完全正确的情况下,请分析导致乙组实验实验反应后天平不平衡的原因.
-
(3) 【实验结论】化学反应都遵守质量守恒定律.
【实验反思】从微观角度分析化学反应遵守质量守恒定律的原因是:化学反应前后,原子的质量、、均不变.

【查阅资料】①白磷一般在40℃左右燃烧,而红磷要在240℃左右才能燃烧白磷在空气中燃烧生成的白烟会污染空气;
②氢氧化钠与二氧化碳发生反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
-
(1) 根据质量守恒定律,首先确定A装置不能验证质量守恒定律,理由是.
-
(2) 根据实验装置的设计,又确定装置验证质量守恒定律会导致实验失败,理由是;
-
(3) B装置可以验证质量守恒定律,为了使实验更环保,可采用的方法使瓶中的白磷燃烧,确保装置始终密闭.
-
(4) C装置中NaOH溶液的作用是,若把NaOH溶液全部清除,实验(填“能”或“不能”)成功,理由是.

-
(1) 实验A中发生反应的化学方程式为。
-
(2) 上述实验中,不能用于验证质量守恒定律的是(填实验序号),其原因是。

 探究质量守恒定律
B .
探究质量守恒定律
B .  探究燃烧的三个条件
C .
探究燃烧的三个条件
C .  测定空气中氧气的含量
D .
测定空气中氧气的含量
D .  探究铁生锈的条件
探究铁生锈的条件

-
(1) 实验一中,将铁钉浸到硫酸铜溶液中,发生反应的化学方程式为。观察到的现象是,成功验证质量守恒定律。
-
(2) 实验二中,反应前后天平不平衡,用文字结合化学方程式解释其原因。
-
(3) 实验三中,称量镁条和石棉网的质量后,点燃镁条,观察到,再称量指针指在刻度盘中央,无法验证质量守恒定律。该反应的化学方程式为。

-
(1) 蜡烛燃烧过程中,天平的盘(填“左”或“右”)逐渐下沉。
-
(2) 根据质量守恒定律解释天平失去平衡的原因。
 B . 生成炭黑的实验
B . 生成炭黑的实验  D . 比较空气与人体呼出的气体中CO2含量
D . 比较空气与人体呼出的气体中CO2含量 

实验一:称量镁条的质量,在空气中点燃,待反应结束、冷却后,再称量生成白色固体的质量。
实验二:如图甲,将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后将两种溶液混合 (有蓝色氢氧化铜沉淀和硫酸钠生成),过一会儿再称量。
实验三:如图乙,将装有稀盐酸的小试管放入装有大理石的烧杯中,称量,然后将稀盐酸与大理石混合,过一会儿再称量。实验数据见表:
| 编号 | 实验一 | 实验二 | 实验三 |
| 变化前 | 4.8g | 118.4g | 112.6g |
| 变化后 | 8.0g | 118.4g | 111.0g |
-
(1) 表中数据看,这三个实验过程中,发生化学反应的前后物质质量(填“减小“增大”或“不变”):实验一,实验二,实验三。
-
(2) 这三个实验中,实验(选填:“一”、“二”或“三”)正确地反映了反应物与生成物之间的质量关系。
-
(3) 从不能正确反映反应物和生成物之间质量关系的实验中,选择其中一个说明实验设计中的不当之处,请写出该实验所发生反应的化学方程式。
-
(4) 由此可得出,在选用有气体参加或生成的化学反应来验证质量守恒定律时,必须在(填“密闭”或“开放”)的体系中进行。
 B . 探究硝酸钾溶解度与温度的关系
B . 探究硝酸钾溶解度与温度的关系 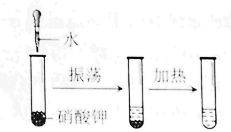 C . 探究水的组成元素
C . 探究水的组成元素  D . 验证质量守恒定律
D . 验证质量守恒定律 
 , B的反应化学方程式为
, B的反应化学方程式为  ,请根据图示回答问题:
,请根据图示回答问题: 
-
(1) 甲同学设计的实验如图A所示,实验时将试管中的硫酸铜溶液倒入烧杯中的氢氧化钠溶液中,试管仍然放回烧杯,反应时烧杯中的现象是。
-
(2) 乙同学设计的实验如图B所示,实验时将试管中的稀盐酸倒入烧杯中与碳酸钙粉末混合,试管仍然放回烧杯,两种物质反应后,天平的读数填(“减小”、“不变”或“增大”),原因是。
-
(3) 丙同学在老师的引导下,最终也使天平平衡了,其初次称量不平衡的原因可能是。
-
(4) 从微观角度分析,在化学反应前后一定不变的是(选填序号)。
①原子种类、数目 ②分子种类、数目 ③原子质量 ④分子质量

| 实验序号 | 1 | 2 | … |
| m1(MnO2)/g | |||
| m2(试管+KClO3)/g | |||
| m3(试管+加热后剩余固体)/g | |||
| 量筒内收集气体的体积V/cm3 |
-
(1) 给试管中的固体加热时,发现试管炸裂,可能原因为。
A 试管外壁干燥
B 试管接触灯芯
C 试管口朝向人
D 试管口没有略向下倾斜
-
(2) 根据质量守恒定律,m1、m2、m3和V和p之间应存在的等量关系为;
-
(3) 每次实验结束后,小金在拆卸装置时总能闻到刺激性气味。他将加热后剩余固体中的MnO2分离并测量其质量,发现总小于加热前MnO2的质量。查阅资料后发现,一般认为加热KClO3和MnO2混合物的反应过程如下:
第1步:
 ;(其中Cl2有刺激性气味)
;(其中Cl2有刺激性气味)第2步:

第3步:
 。
。①第3步中X的化学式为。
②写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因。
| 选项 | 实验操作 | 现象或变化 | 结论 |
| A | 取少量井水,加入适量肥皂水,振荡 | 产生大量浮渣 | 井水为硬水 |
| B | 称量镁条在空气中燃烧前后质量 | 质量减少 | 不遵循质量守恒定律 |
| C | 把引燃的细铁丝伸进盛有氧气的集气瓶中 | 剧烈燃烧 | 氧气有可燃性 |
| D | 用拇指堵住收集了CH4的试管口,靠近火焰,移开拇指点火 | 发出尖锐爆鸣声 | 试管中CH4纯净 |
一段时间后,可以观察到烧杯中现象是,反应完成后天平指针的位置在(选填左侧、右侧、中间)。


-
(1) 实验1中,最终流入集气瓶中的水的体积小于
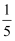 ,原因可能是。
,原因可能是。
-
(2) 实验2中气球的作用是。该实验可验证质量守恒定律,由上述实验可知,化学反应前后一定不发生改变的是(填序号)。
①物质总质量 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类
-
(3) 实验3中通入氧气,a处白磷不燃烧,b处白磷燃烧,说明可燃物燃烧的条件之一是。

-
(1) 图A是“测定红磷燃烧前后的质量变化情况”实验装置图。
①将图A中的玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速塞入锥形瓶并塞紧橡皮塞,使玻璃管下端接触红磷,使红磷燃烧。之后,锥形瓶内可观察到的现象是。
②实验过程中气球的变化情况是。
-
(2) 图B是“测定稀盐酸与石灰石反应前后的质量变化情况”实验装置图。
待托盘天平按图示平衡后,将稀盐酸倒入烧杯中与石灰石粉末充分反应,烧杯中不再产生气泡后再观察托盘天平平衡情况,反应的符号表达式为。
-
(3) 上述两种装置中,能得出“反应前后物质的总质量不变”结论的装置是(填“A”或“B”),不选另一个装置的理由是。


-
(1) 小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我(填“同意”或“不同意”)小明的观点,因为。
小红按图1装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。经研究该黄色固体是Mg3N2 , 为了证明镁可在氮气中燃烧生成氮化镁,小红设计了如下方案进行验证。
-
(2) (进行实验)
步骤Ⅰ:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图2所示的装置;另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条。
步骤Ⅱ:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的
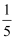 左右。
左右。步骤Ⅲ:步骤Ⅱ结束后,往水槽中加水使广口瓶内外水面相平。点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量,蒸发皿中有黄色固体出现。待冷却后广口瓶内水位继续上升。
①写出镁在氮气中燃烧生成氮化镁的化学方程式。
②步骤Ⅱ的目的是。
③在步骤Ⅲ“待冷却后广口瓶内水位继续上升”是由于瓶内气压(填“大于”“小于”或“等于”)外界气压。
-
(3) (实验拓展)
空气中氧气含量测定实验(填“能”或“不能”)用镁带替代红磷,原因是。
-
(4) 空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却大于Mg3N2。请给出合理的解释。

-
(1) 哪一组能验证质量守恒定律?并写出该组中发生反应的化学方程式。
-
(2) 请解释另一组实验不能验证质量守恒定律的原因。

-
(1) A是验证质量守恒定律的实验,实验过程中红磷的用量,对实验结果 (填“有"或“无")影响,实验中气球的作用是。
-
(2) B实验中玻璃棒的作用是。
-
(3) C是验证可燃物燃烧条件实验,烧杯内蜡烛燃烧会 儿就熄灭了,而空气中的蜡烛持续燃烧,说明可燃物燃烧的条件之一是 。
 B . 探究铁钉生锈需要氧气
B . 探究铁钉生锈需要氧气 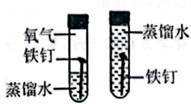 C . 验证质量守恒定律
C . 验证质量守恒定律  D . 证明二氧化碳的密度比空气大
D . 证明二氧化碳的密度比空气大 



