根据化学反应方程式的计算 知识点
根据化学反应方程式的计算 知识点题库
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
盐酸的质量/g | 25 | 25 | 25 | 25 |
烧杯及所盛物质总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
请你据此分析计算:
-
(1) 第一次加入盐酸充分反应后,生成二氧化碳的质量是g.
-
(2) 该产品中碳酸钠的质量分数是否合格?(写出计算过程,结果精确到0.1%)

-
(1) 小亮从瓶中取出50mL溶液,稀释成10%的H2O2溶液待用,理论上他需要加水mL。
-
(2) 小丽同学用上述稀释后的H2O2溶液和下图二装置探究不同物质对H2O2的催化效果是否相同。实验中她看到左侧试管比右侧试管中产生气泡的速率快,此外还观察到,说明MnO2对此反应的催化效果比水泥好。请判断该实验设计是否合理并说明理由:。

-
(3) 小杰同学用上图三装置测定上述稀释后的H2O2溶液的溶质质量分数是否为10%,反应前他在分液漏斗中加入50 g稀释后的H2O2溶液,在干燥管中加入足量无水氯化钙,并在广口瓶中加入适量MnO2样品,共称得装置和药品的总质量力564.57g。打开分液漏斗活塞,使H2O2溶液全部流入瓶中,迅速关紧活塞,待反应结束后,称得装置及其内所有物质的总质量为562.97g。
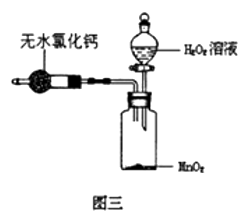
①请计算上述稀释后的H2O2溶液的溶质质量分数与10%是否相符?(请写出具体计算过程)
②若不符合,其可能的原因是。(注:若符合,此问不作答)

-
(1) 写出仪器a的名称。
-
(2) 实验室用氯酸钾和二氧化锰制取氧气的化学方程式为,若要收集较纯净的氧气可选用的收集装置是(填字母)。
-
(3) 实验室用大理石与稀盐酸制取二氧化碳的化学方程式为,可选用的发生装置是(填字母),若制取较多二氧化碳,可将该装置中试管换成。
-
(4) 实验室将A装置稍加改动可用于高锰酸钾制取氧气。按此反应,试计算制取0.64g氧气理论上需要高锰酸钾的质量是多少?(写出计算过程)
-
(1) 【实验一】同时将足量的稀盐酸倒入锥形瓶甲和锥形瓶乙中。
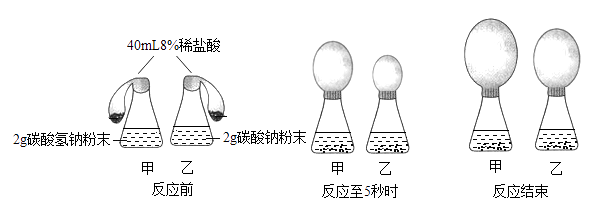
反应至5s生成气体的速率:碳酸氢钠碳酸钠(选填“>”、“<”或“=”)
-
(2) 【实验二】分别将足量的稀盐酸逐滴滴入试管甲和试管乙中,边滴边震荡

现象为:
①试管甲中的溶液开始时显浅红色,逐滴滴加稀盐酸立即产生大量气泡,浅红色逐渐消失。
②试管乙中的溶液开始时显红色,滴入稀盐酸没有气泡产生,溶液颜色逐渐变为浅红色后,继续滴加稀盐酸有大量气泡产生,浅红色逐渐消失。
【反思1】在【实验二】碳酸钠溶液中逐滴滴加人稀盐酸,为何刚开始没有大量气泡产生?研究小组查阅资料,绘制出微观示意图。

①碳酸钠溶液中逐滴滴加稀盐酸,一次发生反应的化学方程式为:、
②相同浓度的碳酸氢钠溶液和碳酸钠溶液的碱性:碳酸氢钠碳酸钠(选填“>”、“<”或“=”)
-
(3) 【反思2】为何【实验一】中碳酸氢钠最终产生气体的体积较大?
请你列式计算:【实验一】中两种固体完全反应后产生气体的质量各是多少?(写出计算过程,结果保留到0.1g)
|
时间/s |
0 |
30 |
60 |
90 |
120 |
150 |
180 |
|
质量/g |
0 |
30 |
50 |
60 |
66 |
66 |
66 |
-
(1) 写出CO2被足量的NaOH溶液吸收时,发生的化学反应方程式。
-
(2) 从表格中可以看出,200g水垢与盐酸反应生成的CO2最多是 g
-
(3) 计算水垢中碳酸钙的质量分数,写出计算过程
|
实验次数 |
1 |
2 |
3 |
4 |
|
稀盐酸的用量 |
5g |
5g |
5g| |
5g |
|
剩余固体的质量 |
1.5g |
1.0g |
0.5g |
0.3g |
-
(1) 从以上数据可知,这四次实验中,第次石灰石样品中的碳酸钙已完全反应?
-
(2) 石灰石样品中碳酸钙的质量分数是。
-
(3) 求第一次实验产生的CO2的质量。(要求写出计算过程)
请回答:
-
(1) 生成氧气g
-
(2) 剩余固体中存在那些物质?各为?
 。某化学兴趣小组同学们思考:若向碳酸钠溶液中通入一定量二氧化碳,是否能生成碳酸氢钠(NaHCO3)?于是他们开始实验探究。(不考虑二氧化碳和碳酸作为溶质的情况)
。某化学兴趣小组同学们思考:若向碳酸钠溶液中通入一定量二氧化碳,是否能生成碳酸氢钠(NaHCO3)?于是他们开始实验探究。(不考虑二氧化碳和碳酸作为溶质的情况) (提出问题)所得溶液中所含溶质成分是什么?
(查阅资料)碳酸氢钠溶液呈碱性。
(提出猜想)
猜想一:溶质为Na2CO3;
猜想二:溶质为NaHCO3;
猜想三:溶质为。
(设计实验)
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取所得溶液少许于试管中,向其中滴加过量的CaCl2溶液 | 有白色沉淀生成 | 猜想二(填“成立”或“不成立”) |
| 步骤二:取实验步骤一中上层清液,滴加适量稀盐酸 | 有气泡冒出 | 猜想不成立 |
(得出结论)猜想三成立,证明二氧化碳通入碳酸钠溶液生成了碳酸氢钠。
(讨论交流)小明同学认为,向碳酸钠溶液中通入一定量二氧化碳后,再向所得溶液中滴加几滴酚酞溶液。溶液变红就能证明一定有碳酸氢钠生成;请你对小明同学的结论作出评价。
(解释与交流)为了准确验证溶液中溶质的成分,在实验的过程中的试剂选择需要注意。
(拓展应用)同学们回忆起实验室用澄清石灰水检验二氧化碳的情景,结合上述知识,如果向一定量的澄清石灰水中不断通入二氧化碳气体,下列图像能符合题意反映变化关系(填字母序号)。
A、 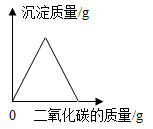
B、 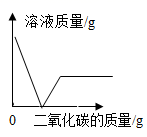
C、 
D、 
试计算:
-
(1) 生成氧气的质量为多少克?
-
(2) 反应前,氯酸钾和二氧化锰的质量各为多少克?
 中,B、D的相对分子质量之比为8:11。若1.6gA与6.4gB恰好完全反应,则生成C的质量为( )
中,B、D的相对分子质量之比为8:11。若1.6gA与6.4gB恰好完全反应,则生成C的质量为( )

-
(1) 步骤一中发生反应的化学方程式为。
-
(2) 步骤二中操作X所用到的玻璃仪器有、烧杯、玻璃棒,其中玻璃棒的作用是,操作Y的名称是。
-
(3) 实验前所加二氧化锰的质量为克。
-
(4) 试计算该实验小组所取氯酸钾的质量。(写出计算过程)
-
(1) 生成沉淀的质量是g。
-
(2) 求碳酸钠溶液中溶质的质量分数是多少?

-
(1) 产生的二氧化碳的质量是g。
-
(2) 此纯碱样品中碳酸钠的质量分数(写出必要的计算过程,结果保留到0.1%)
-
(1) 产生二氧化碳多少克?
-
(2) 所得溶液中溶质的质量分数是多少?
-
(1) 主题Ⅰ:探究氯化钠样品中杂质的成分
已知所提供的氯化钠样品中,可能含有硫酸钠、氯化镁、氯化钙中的一种或几种杂质,甲同学的实验探究过程记录如图:

根据以上实验信息,甲同学得出结论:此氯化钠样品中含有的杂质是硫酸钠。
【实验分析】
步骤①中加入适量NaOH溶液的目的是。
-
(2) 乙同学认为步骤③中不需要加入足量稀盐酸,你是否同意他的观点?(选填“同意”或“不同意”),请说明原因。
-
(3) 主题Ⅱ:测定氯化钠样品中氯化钠的质量分数
确定了氯化钠样品中杂质的成分后,甲同学对样品中氯化钠的质量分数进行测定。称取30.0g氯化钠样品于烧杯中,加足量的水充分溶解,再向其中加入氯化钡溶液至不再产生沉淀为止,沉淀经过滤、洗涤、干燥后称量,其质量为4.66g。请计算该样品中氯化钠的质量分数。(写出计算步骤,计算结果精确到0.1%)



