根据化学反应方程式的计算 知识点题库
反应前物质的质量/g | 充分反应后物质的质量/g | |
铁画边角料 | 稀硫酸 | 剩余固体和液体的总质量 |
8.5 | 170 | 178.2 |
-
(1) 产生气体的质量为 g
-
(2) 样品中铁的质量是多少?
-
(3) 样品中金的质量分数是多少?(结果保留一位小数)
-
(1) 原混合物中硫酸钠的质量分数;
-
(2) 反应后所得溶液中溶质的质量分数.
-
(1) 硫酸钾中钾、硫、氧的原子个数比是,氯化钾的相对分子质量是.
-
(2) 200克该品牌的钾肥中硫酸钾的质量是多少?
-
(3) 反应后所得氯化钾不饱和溶液中溶质的质量分数是多少?
烧杯 | 大理石 | 稀盐酸 | 反应后烧杯及其中物质总质量 | |
质量(g) | 90 | 8.5 | 50 | 145.2 |
-
(1) 实验中判断碳酸钙完全反应的方法是,大理石是重要的建筑材料,在实际应用中应避免与接触.
-
(2) 实验中产生的二氧化碳质量为.
-
(3) 求该大理石的纯度(写出计算过程,计算结果精确到0.1%)
-
(1) 反应中产生的CO2的质量;
-
(2) 纯碱中Na2CO3的质量分数.
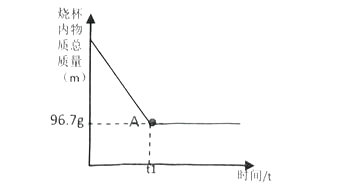
-
(1) 对于反应过程来说,A点表示:
-
(2) 实验过程中生成CO2克。
-
(3) 求20克鸡蛋壳中含碳酸钙的质量?
-
(4) 求20克鸡蛋壳中含钙元素的质量?
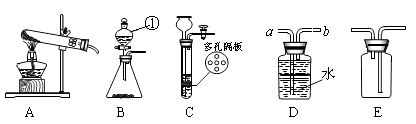
-
(1) 写出图中有标号仪器的名称: ①。
-
(2) 用高锰酸钾制取一瓶干燥的氧气,可选用装置组合为(选填序号);实验室制取二氧化碳和氧气可选用发生装置C或B,C装置的优点是,用此装置制取O2的化学方程式是;
-
(3) 实验室常用甲酸(HCOOH)溶液滴加到浓硫酸中制CO气体,可选用的制取装置是(选填序号)。该反应中浓硫酸既是催化剂又是脱水剂,试写出该反应的化学方程式。
-
(4) .Ⅱ.某同学将氢氧化钠溶液滴入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色固体的现象产生疑惑。
【查阅资料】CuCl2溶液与NaOH溶液反应可生成蓝色固体(Cu(OH)2),在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜(Cux(OH)yClz),其不溶于水,能与酸反应。
Cu(OH) 2在60℃开始分解生成两种氧化物,100℃分解完全。碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全。
【猜想】蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③。猜想①的理由是:(用化学方程式表示)。
【验证】该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体。则猜想 不符合题意。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图(选填“甲”或“乙”)装置(装置中药品足量)。
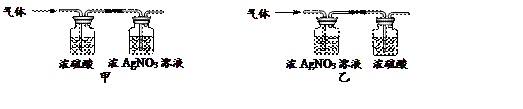
【实验数据】 ①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g;
③浓硫酸装置中数据如表。
加热前
100℃
400℃
250.00g
251.80g
253.60g
【得出结论】猜想③成立,且碱式氯化铜中X∶Y:Z = 。
【拓展延伸】
为使实验中生成蓝色固体,少出现蓝绿色固体,应作改进(选填序号)。
a . 实验中将氯化铜溶液滴加到氢氧化钠溶液中
b.实验中应提供足量、较浓的氢氧化钠溶液
c.实验应该在80℃的水浴中进行
-
(1) 生成氧气的质量。
-
(2) 原混合物中氯酸钾的质量。
-
(3) 反应结束后.二氧化锰的质量。
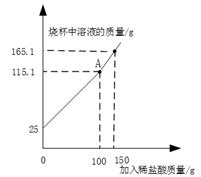
求:
-
(1) 产生CO2的总质量为g。
-
(2) 鸡蛋壳中碳酸钙的质量分数。
-
(1) 求生成CO2的质量;
-
(2) 通过计算说明,小林同学购买的食醋中醋酸的含量是否合格。
-
(3) 生活中有时会用到稀食醋。要配制醋酸质量分数为1%的稀食醋100g,需要上述食醋多少克?
-
(1) 脱氧剂中主要成分为铁粉,右图为铁与氧气在不同条件下的反应。
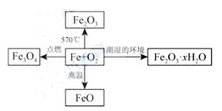
根据右图判断,铁与氧气反应的产物与 有关,常温下,脱氧剂中铁粉脱氧的产物是(填化学式),写出铁与氧气反应生成氧化亚铁的方程式。
-
(2) 该品牌脱氧剂还可以吸收SO2等有毒气体,这是利用了活性炭的性。
-
(3) 为了探究久置的该品牌脱氧剂中铁粉是否变质,实验兴趣小组取其中一包该品牌脱氧剂,将固体全部倒入烧杯(无固体酒落和残留),再向烧杯中加入足量的稀盐酸,烧杯总质量与反应时间的关系如下表所示:
反应时间/min
0
t1
t2
t3
烧杯总质量/g
159
158.96
158.92
158. 9
①完全反应后生成气体的质量为g。
②请通过计算判断该脱氧剂是否发生变质(根据化学方程式的计算写出完整的计算步骤)。
 2CaSO4+2CO2)
2CaSO4+2CO2)

| 实验编号 | 药品 |
| Ⅰ | 6.5g锌块、150g 含HCl7.3%足量的稀盐酸 |
| Ⅱ | 6.5g锌粒、150g 含HCl7.3%足量的稀盐酸 |
| Ⅲ | 6.5g锌粉、150g 含HCl7.3%足量的稀盐酸 |
-
(1) 小组按图一装置进行的三个实验中,实验(填实验编号)反应速率最慢;在图二中的曲线(填“甲”、“乙”或“丙”)代表的是实验Ⅲ,从曲线甲、乙、丙得出探究结论是:。
-
(2) 分析表中锌和稀盐酸的用量可知:(填物质名称)反应消耗完;
-
(3) 请计算以上任意一组实验中生成氢气的质量(写出具体计算过程)。
-
(4) 分析上表数据,请在图三中画出在6.5g锌中加入0~150 g稀盐酸过程中,产生氢气质量对应的变化曲线图,并标注必要的数值。


-
(1) 生成CO2的质量。
-
(2) 22.8g样品中氯化钠的质量为。
-
(3) 计算所得溶液中溶质的质量分数。(写出解题过程,计算结果精确到0.1%)
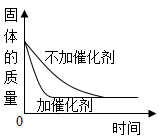 用等质量氯酸钾制取氧气
B .
用等质量氯酸钾制取氧气
B . 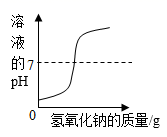 向稀盐酸中滴加过量的氢氧化钠溶液
C .
向稀盐酸中滴加过量的氢氧化钠溶液
C . 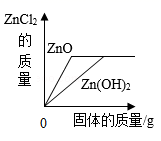 向等质量、等质量分数的两份稀盐酸中分别加入足量的ZnO和Zn(OH)2
D .
向等质量、等质量分数的两份稀盐酸中分别加入足量的ZnO和Zn(OH)2
D . 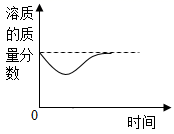 某温度时,向一定量的饱和石灰水中加入少量的生石灰
某温度时,向一定量的饱和石灰水中加入少量的生石灰

-
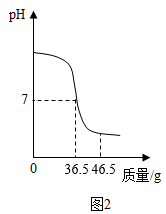
(1) 仪器A中溶液的溶质是(填化学式),图1烧杯中溶液的溶质各元素的质量比。
-
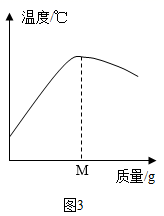
(2) 图3中M的数值最接近g。
-
(3) 求所用氢氧化钠溶液的溶质质量分数(写出计算过程)。
-
(1) 生成氢气的质量是g。
-
(2) 计算黄铜样品中锌的质量分数。(结果精确至0.1%)。



