根据化学反应方程式的计算 知识点题库
人类的生产生活离不开金属。
(1)铁生锈的条件是铁与 直接接触。
(2)铜制品如果长期暴露在空气中也会生锈,已知铜锈化学式为Cu2(OH)2CO3。试判断铜生锈除满足铁生锈的上述条件外,还需要空气中的 。
(3)在生活中经常用一些铝制品代替铁,铝耐腐蚀的原因是 。[填序号]
A. 铁比铝活动性弱
B. 铝与氧气反应在其表面生成致密的氧化物保护膜
C. 常温下,铝不与稀盐酸、稀硫酸等稀酸溶液反应
(4)如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是 。[填序号]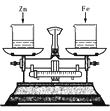
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左
(5)向一定量的铁粉中逐滴加入稀硫酸至过量,右图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y可能表示 。[填序号]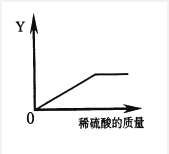
A.消耗铁粉的质量 B.生成硫酸亚铁的质量
C.溶液的总质量 D.生成氢气的质量
测定次数 | 生成沉淀的质量(g) | 生成水的质量(g) |
1 | 5 | 0.9 |
2 | X | 2.7 |
3 | 20 | 3.6 |
4 | 20 | 3.6 |
请分析数据,回答下列问题:
-
(1) 组成孔雀石的元素有.
-
(2) 表中“X”的值为 g.
-
(3) 实验最终生成二氧化碳的质量是多少克(写出计算过程)?
-
(1) 该样品中碳酸钙的质量为
-
(2) 计算12.5g该样品最多可以制得二氧化碳的质量,写出必要的计算过程.
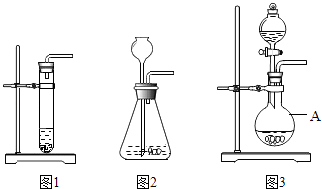
-
(1) 写出实验室制取CO2的化学方程式;
-
(2) 仪器A的名称是;
-
(3) 利用图2装置制取CO2时,长颈漏斗的下端管口必须浸没在溶液中,理由是;
-
(4) 图1和图3装置相比,利用图1装置来制取CO2时,主要不足是(写出一点即可);
-
(5) 化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定质量的石灰石样品,将20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用量
剩余固体的质量
第一次加入5g
1.5g
第二次加入5g
1.0g
第三次加入5g
0.5g
第四次加入5g
0.3g
石灰石样品中碳酸钙的质量分数为;
原稀盐酸中溶质的质量分数为多少?(写出计算过程)
-
(1) 定性检测废水
检测废水呈酸性的方法是 .
-
(2) 配制200g质量分数为5.6%的氢氧化钾溶液
①计算
m(KOH)= g,V(H2O) mL(水的密度近似为1.0g•mL﹣1).
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量.然后 (按操作先后顺序,填字母),直至天平平衡.
A .向烧杯中加氢氧化钾固体 B .按需要添加砝码、移动游码
C .量取; D .溶解 E .转移.
-
(3) 定量测定废水
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示.(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
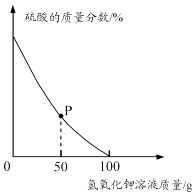
①P点对应溶液中一定存在的阳离子有 (填离子符号).
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%).
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.1%).
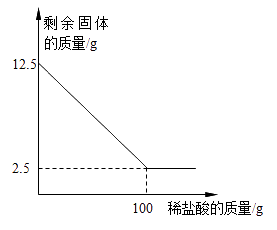
-
(1) 石灰石中碳酸钙的质量分数是。
-
(2) 实验中产生的二氧化碳的质量是多少?(写出计算过程)
-
(1) 该反应生成二氧化碳的质量为多少g;
-
(2) 求该纯碱样品中碳酸钠质量分数为多少(写出计算过程)。
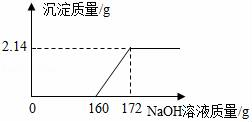
-
(1) FeCl3与NaOH恰好完全反应时,生成沉淀的质量是多少g。
-
(2) 该工业盐酸中HCl的质量分数是多少(写出计算过程)
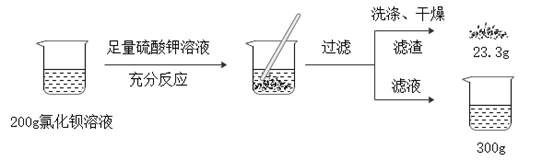
求:
-
(1) 所用氯化钡溶液溶质的质量分数?
-
(2) 所得滤液可用作钾肥,钾肥除了抗病虫害外还具有作用。
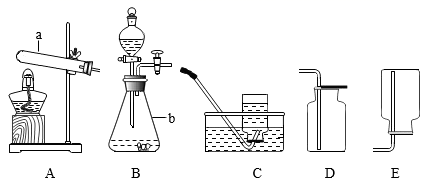
-
(1) 写出标有序号的仪器名称ab;
-
(2) 工业上我们常用分离液态空气法制取氧气,空气中的各成分的沸点如下:
组分
氮气
氧气
二氧化碳
氩气
氖气
氦气
沸点(℃)
-195.8
-183
-74.8
-185.7
-246
-268.9
先将空气加压降温至-200℃,变成液态,再升温至-195℃,则逸出的物质是;剩下的物质是(填“纯净物”或“混合物"),该过程属于变化(填“物理”或“化学”);
-
(3) 实验室用过氧化氢溶液与二氧化锰混合制取O2 , 化学方程式为,该反应的基本类型是反应。可选用的发生装置是,能选择D作为收集装置的理由是,用该方法收集氧气检验氧气已收集满的方法是。
-
(4) 实验室常用氯化铵固体与碱石灰固体共热来制取一种易溶于水密度比空气小的氨气(NH3),应选择的制取装置组合是(填上图字母),如果用图所示装置收集氨气,气体应从(填“c”或“d”)端管口通入。
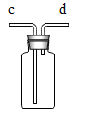
-
(5) 实验室用氯酸钾与二氧化锰混合制取氧气,二氧化锰起作用,待氯酸钾完全反应后,将剩余固体用以下方法分离:(资料氯化钾易溶于水,二氧化锰难溶于水)
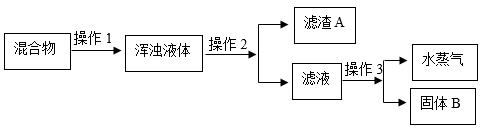
其中操作1、2、3都用到的一种玻璃仪器是,操作2中该玻璃仪器的作用,操作3的名称为。
-
(6) 学生在实验室中用老师提供的氯酸钾和二氧化锰的混合物16.0g为原料制取氧气,加热一段时间后,产生氧气0.15mol。则分解的氯酸钾的质量是多少克?。(用化学方程式计算)
-
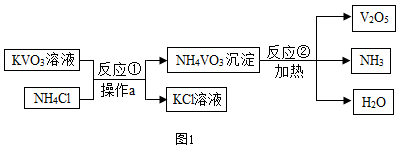
(1) 操作a的名称是。
-
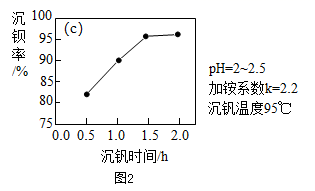
(2) 图2表示反应①的沉钒率随时间变化的情况,为使生成沉淀的效率较高,反应①适合的时间是小时。
-
(3) 反应② “
 ”中在制备182 g V2O5的同时生成NH3的质量为g。
”中在制备182 g V2O5的同时生成NH3的质量为g。
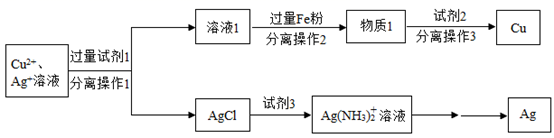
-
(1) 加入过量Fe粉发生的主要反应为(写化学方程式)。
-
(2) 试剂1和试剂3的名称依次是。
-
(3) 若向66g物质1中加入100g试剂2后,恰好完全反应,剩余固体质量为60.4g,求所得溶液中溶质的质量分数(写出计算过程,计算结果精确到0.1%)。
-
(1) CaH2中氢元素的化合价为;
-
(2) 氢化钙需要保存(答出一点即可)
-
(3) 现有84 g氢化钙与足量水反应,可生成H2克?
-
(1) 生成氧气的质量。
-
(2) 求生成物中氯化钾的质量。(写出计算过程)
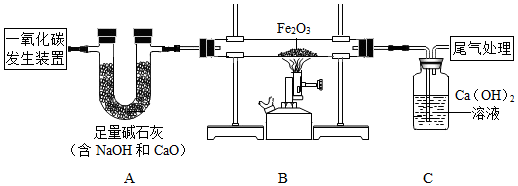
-
(1) 写出装置C处尾气处理的方法(写一种即可);A装置中有关反应的化学方程式。(写出一个即可)
-
(2) 检验CO还原Fe2O3反应的气体生成物的现象是什么?。
-
(3) 实验后取A中固体溶于水,滴加酚酞溶液,溶液变红色,请分析可能的原因。
-
(4) 某钢铁厂用赤铁矿石炼铁。若该厂每天需消耗6000t含氧化铁80%的赤铁矿石,则理论上可日产含铁96%的生铁的质量是多少?(写出计算过程)
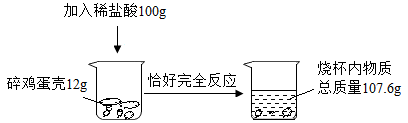
-
(1) 计算鸡蛋壳中碳酸钙的质量分数。
-
(2) 计算反应后所得溶液中溶质的质量分数。(写出计算过程,精确到0.1%)
-
(1) 探究燃烧条件,并粗略测定空气中氧气的含量:如图所示,在玻璃管中放置足量的红磷和白磷,塞好橡皮塞,关闭K,观察到红磷不燃烧而白磷燃烧。
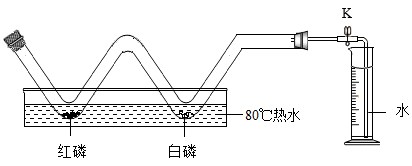
①产生上述现象的原因是。
②写出发生反应的化学方程式。
③若量筒中原有水a毫升,最终剩余的水为b毫升,玻璃管的容积为c毫升,则测定的空气中氧气体积比例为(用字母表示)。
-
(2) 某兴趣小组在密闭的装置内燃烧某种含有碳、氢、氧元素的物质。将产生的气体(不考虑气态有机物)通过如图所示的装置进行检验(无水硫酸铜遇水变蓝色)。
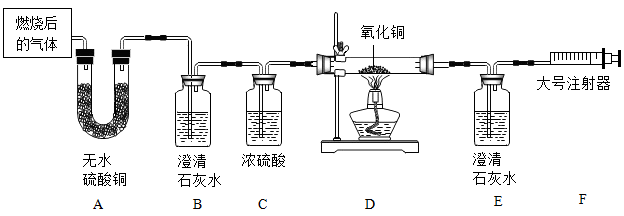
①实验中观察到D处黑色固体变成红色,则D装置中发生反应的化学方程式为。
②装置中浓硫酸的作用。
③该兴趣小组小金同学认为,仅根据E中澄清石灰水变浑浊,无法确定一氧化碳的存在,其理由是。
④F处的大号注射器,可以引导气体流向,其另一个主要作用是。
-
(3) 实验室用碘化氢溶液测定过氧化氢溶液中溶质的质量分数,反应原理为
 , 取25g过氧化氢溶液,加入足量的碘化氢溶液,充分反应后生成12.7g的碘,请计算该过氧化氢溶液中溶质的质量分数。
, 取25g过氧化氢溶液,加入足量的碘化氢溶液,充分反应后生成12.7g的碘,请计算该过氧化氢溶液中溶质的质量分数。
 CaCO3+H2O+CO2↑,碳酸钙在高温下会继续分解产生氧化钙。如图是32.4g碳酸氢钙固体加热过程中固体质量随温度的变化关系。请回答:
CaCO3+H2O+CO2↑,碳酸钙在高温下会继续分解产生氧化钙。如图是32.4g碳酸氢钙固体加热过程中固体质量随温度的变化关系。请回答:
-
(1) 碳酸氢钙属于。(填“酸”“碱”或“盐”)
-
(2) 加热至℃时,碳酸氢钙分解完全。
-
(3) 利用图像数据计算生成氧化钙的质量。(写出计算过程)
-
(4) 32.4g碳酸氢钙固体在整个加热过程中释放二氧化碳的总质量为g。



