根据化学反应方程式的计算 知识点题库
将10.6g碳酸钠与50g稀盐酸放入同一烧杯中,二者恰好完全反应.试计算:稀盐酸中溶质的质量分数.(写出计算过程)
下列反应发生后,溶液的总质量会减少的是( )
A . Fe+H2SO4
B . Fe+AgNO3
C . Fe(OH)3+HCl
D . Fe2O3+HNO3
实验室有一瓶含有硫酸的废液,老师请小红同学设计方案测定该废液中硫酸的溶质质量分数.小红同学先取一洁净小烧杯,称其质量为16.2g,然后往其中倒入少量硫酸废液后称量,总质量为56.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去掉铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为66.8g.
请回答下列问题:
-
(1) 写出上述反应的化学方程式:.
-
(2) 反应中产生的气体的质量是 g.
-
(3) 计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数).
-
(4) 如果铁钉的铁锈未除净,对计算结果的影响是 (选填“偏大”、“偏小”、“无影响”),原因是.
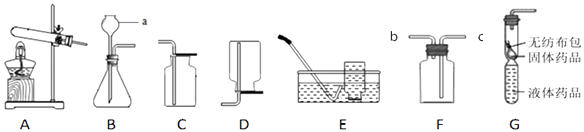
如图为实验室制取气体的常用装置
-
(1) 仪器a的名称是.
-
(2) 以A为发生装置,用高锰酸钾制取氧气化学方程式为,试管口放一团棉花的作用是.
-
(3) 若用装置E收集的氧气不纯,原因可能是(写一种).
-
(4) 用装置F收集氧气,验满时将带火星的木条放在(选填“b”或“c”)处.
-
(5) 以B为发生装置制取二氧化碳,加入药品之前要先检查装置的.装置G是用软塑料管自制的气体发生装置,利用该装置可制取二氧化碳气体,软塑料管中的液体药品是,药品加入完毕后,接下来的操作是:.
-
(6) 实验室用石灰石与稀盐酸制取二氧化碳.按此反应,试计算12.5g含碳酸钙80%的石灰石与足量的盐酸反应,理论上生成二氧化碳的质量是多少?
化学源于生活,生活中蕴含着许多化学知识.
-
(1) 用洗洁精清洗油污,是利用了洗洁精的作用.
-
(2) 生活中将硬水转化为软水常用的方法是.
-
(3) 炒菜时油锅中的油不慎着火,可用锅盖该灭,其灭火原理为.
-
(4) 用漏勺捞煮好的方便面,与化学基本操作中的原理相似.
-
(5) 食盐是维持人体正常生理活动必不可少的物质.人体细胞中约含NaCl0.9%,病人如因食盐摄入量不足,就需要补充溶质质量分数约为0.9%的生理盐水.小轩想检验某瓶生理盐水的含盐质量分数是否合格,他从该瓶生理盐水中取出130g溶液,然后加入足量硝酸银溶液,充分反应后过滤、洗涤、干燥,得到2.87g沉淀(已知NaCl+AgNO3═AgCl↓+NaNO3).请你通过计算帮助小轩判断这瓶生理盐水的含盐质量分数是否合格?
小明奶奶从市场上买来一瓶补钙剂。小明为了检验该产品是否合格,取5片补钙品放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了1.1g.请完成下列问题:

-
(1) 质量减少了1.1g,是因为生成了气体(写化学式)
-
(2) 5片钙片中CaCO3的质量为g;(写计算过程)
-
(3) 5片钙片中实际含钙量为g
-
(4) 该补钙品含钙量 (填“合格”或“不合格”)。
往12g铝和铁的混合物中加入足量的稀硫酸,充分反应后,产生1g氢气,则混合物中铝的质量分数为( )
A . 62.3%
B . 63.2%
C . 36.8%
D . 37.7%
某化学兴趣小组对酸、碱、盐的部分性质进行探究。
-
(1) (探究一)氢氧化钠与二氧化碳反应
甲同学设计实验方案如图1所示
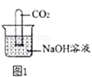
实验现象为,甲同学由此判断氢氧化钠和二氧化碳发生了反应。
-
(2) 小组内其他同学认为甲同学方案不完善,理由是。
-
(3) (探究二)氢氧化钠和盐酸发生中和反应时放出热量。
乙同学向一定量10%的氢氧化钠溶液中滴加10%的盐酸,滴加过程中温度变化如表
加入盐酸体积V/mL
2
4
6
8
10
12
14
16
18
20
混合溶液温度 T/℃
15.2
19.6
22.0
26.0
28.2
26.7
25.7
24.7
23.7
22.9
反应的化学方程式为。
-
(4) 根据表中数据分析混合溶液温度变化的原因。
-
(5) 小组内其他同学提出“将10%的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为是否合理并说明理由。
-
(6) 丙同学将甲同学和乙同学实验后的溶液混合,未发现明显现象。现将混合液中的氯化钠进行提纯,具体的操作为。
-
(7) (探究三)碳酸钠溶液与稀盐酸的分步反应
(查阅资料)向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,第一步反应生成碳酸氢钠和氯化钠,当碳酸钠反应完后才发生第二步反应。
丁同学向106g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为3.65%的稀盐酸,生成二氧化碳的质量变化如图2所示(不考虑CO2的溶解)。
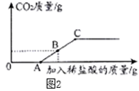
A→C段发生反应的化学方程式为。
-
(8) 若B点横坐标为150,则其纵坐标为。
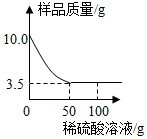
某化学兴趣小组对某假黄金  铜锌合金
铜锌合金  样品进行实验探究,称取样品
样品进行实验探究,称取样品  克于烧杯中,再将
克于烧杯中,再将 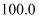 克稀硫酸逐滴滴入,实验情况如图所示。求:
克稀硫酸逐滴滴入,实验情况如图所示。求:
 铜锌合金
铜锌合金  样品进行实验探究,称取样品
样品进行实验探究,称取样品 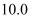 克于烧杯中,再将
克于烧杯中,再将 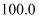 克稀硫酸逐滴滴入,实验情况如图所示。求:
克稀硫酸逐滴滴入,实验情况如图所示。求:
-
(1) 铜锌合金中,锌的质量是。
-
(2) 所用稀硫酸中溶质的质量分数是多少?
实验室有一瓶失去标签的过氧化氢溶液,为测定其溶质质量分数,兴趣小组同学取100g该溶液与1g二氧化锰混合,使其充分反应,产生气体的质量和反应时间关系如图。
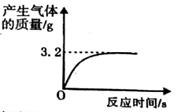
-
(1) 完全反应后,经过滤、烘干,得到固体的质量为(不计操作过程中的损耗)
-
(2) 产生气体的速度越来越慢的原因是_______。A . 二氧化锰越来越少 B . 过氧化氢溶液的溶质质量分数越来越小 C . 温度越来越高
-
(3) 计算所用过氧化氢溶液的溶质质量分数。(规范写出计算过程)
称取12.5g石灰石(主要成分是CaCO3 , 杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计).试计算:
-
(1) 生成的二氧化碳的质量;
-
(2) 石灰石中碳酸钙的质量分数.
氧化亚铜与稀硫酸反应的化学方程式为: Cu2O+H2SO4=CuSO4+Cu+H2O。
-
(1) 氧化亚铜中铜、氧元素质量比为
-
(2) 实验室用98%的浓硫酸配制500g、9.8%的稀硫酸,需要水的质量为
-
(3) 取一定量的氧化亚铜,加入9.8%的稀硫酸恰好完全反应,过滤、洗涤、干燥得红色固体6.4g。计算:
①参加反应的稀硫酸的质量
②反应后所得溶液的质量
某工厂化验室欲测定排放的废水中硫酸的含量(假设废水中只有硫酸与氢氧化钠发生反应)。现取一定量的废水样品,逐滴加入溶质质量分数为10%的氢氧化钠溶液,振荡,当加入氢氧化钠溶液40g时溶液呈中性。求这一定量废水中含H2SO4的质量是多少?(反应的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O
)
下图是实验室制取气体的常用装置。
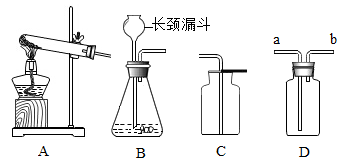
-
(1) 若选用装置A加热高锰酸钾制取氧气,试管口棉花团的作用是,试管中发生反应的化学方程式为,若用装置C收集二氧化碳,验满的方法是。
-
(2) 在实验室里,若选用B装置制取氧气,必须注意,反应的化学方程式为。
-
(3) 图D是一种有洗气、贮气等多种用途的装置,当用排水法收集氢气时,具体的操作方法是;当用此装置收集二氧化碳时,则气体应从(填“a”或“b”)端通入。
-
(4) 现选用B装置制取二氧化碳气体,先向锥形瓶中加入12.5g石灰石,再通过长颈漏斗向其中加入100g足量的稀盐酸,充分反应后(杂质不参加反应),称量固液混合物的质量为108.1g,请计算该石灰石中碳酸钙的质量分数。
向氢氧化钡溶液中滴加稀硫酸溶液至过量,其图像关系如下图所示,横坐标为加入稀硫酸的质量,则下图中纵坐标应为( )
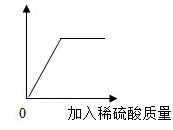
A . 溶液中水的质量
B . 溶液中沉淀的质量
C . 溶液中钡离子的数目
D . 溶液中氢氧化钡的溶质质量分数
二氧化碳能与过氧化钠反应: 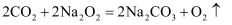 ,该反应常用于潜艇中氧气再生。计算:
,该反应常用于潜艇中氧气再生。计算:
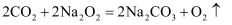 ,该反应常用于潜艇中氧气再生。计算:
,该反应常用于潜艇中氧气再生。计算:
-
(1) 7.8g过氧化钠与足量二氧化碳反应生成氧气的质量。
-
(2) 7.8g过氧化钠与二氧化碳反应过程中,当固体中钠元素质量分数为50%时,此时生成氧气的质量。
工业生产的纯碱中含有少量NaCl杂质。为测定该纯碱中碳酸钠含量(98%以上合格)是否符合标签要求,他称取了纯碱样品11g,全部溶解在64.4g 水中,当加入一定量稀盐酸恰好完全反应,生产气体4.4g,若将所得溶液蒸发50g水后溶质的质量分数变成10%。

-
(1) 通过计算判断该纯碱中碳酸钠含量是否符合标签要求?(精确到0.1%)
-
(2) 蒸发水后所得溶液的质量
-
(3) 所加稀盐酸的溶质质量分数
密闭容器中,下列各组物质在一定条件下充分反应后,冷却至室温,密闭容器中的气态物质为纯净物的是( )
A . 物质的量比为1∶1的C和O2
B . 分子数比为1∶1的CO和O2
C . 质量比为1∶5的CH4和O2
D . 质量比为3∶4的C和O2
碳及其化合物与生产、生活密切相关,是化学学习和研究的重要内容。
-
(1) 常温下,碳的化学性质不活泼。请从原子结构的角度分析原因。
-
(2) 下列关于CO2与CO的比较正确的是(多选题,填字母序号)。
a.CO2可用于人工降雨,CO可用于光合作用
b.通常情况下,CO2能溶于水,CO难溶于水
c.CO2无毒,CO易与血液中的血红蛋白结合引起中毒
d.CO2和CO都具有还原性,都可以做还原剂
-
(3) 如图实验,向试管A、B中通入CO2一段时间后,观察到的化学现象是;该实验证明了。
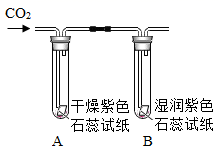
-
(4) 某同学用下图装置(铁架台等略去)制取二氧化碳,并探究二氧化碳的性质。
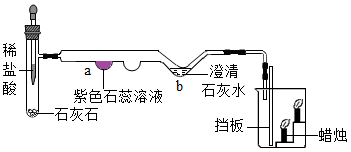
①请用化学方程式解释a处紫色石蕊溶液变红色的原因。
②写出b处发生反应的化学方程式。
③移开挡板后,观察到的现象为。
-
(5) 在实验室里,将25g石灰石样品(杂质不参加反应,也不溶于水)放入盛有100g稀盐酸的烧杯中,恰好完全反应,测得烧杯中物质的总质量为116.2g。求样品中碳酸钙的质量。
催化剂能改变化学反应速率。某实验小组探究了不同催化剂对H2O2分解的催化效果。实验装置如题图1所示。将20.0g溶质质量分数为3.4%的H2O2溶液快速推入装有催化剂的圆底烧瓶中,实验数据见下表:
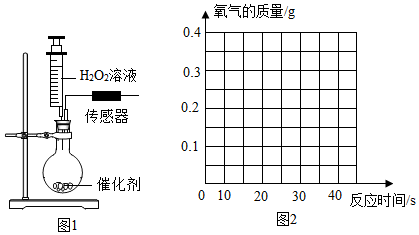
| 实验编号 | 催化剂 | 催化剂的质量(g) | 完全反应所需时间(s) |
| Ⅰ | MnO2 | 2.0 | 25.0 |
| Ⅱ | FeCl3 | 2.0 | 35.0 |
-
(1) 实验前需准备不同浓度的H2O2溶液。若要配制20g溶质质量分数为3.4%的H2O2溶液,需取溶质质量分数为20%的H2O2溶液g(精确到0.1)。
-
(2) 根据实验探究目的,从上表中的实验数据中,可得出结论是。
-
(3) 计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程。
-
(4) 在题图2中画出实验II过程中生成O2的曲线图。
最近更新



